Трифторид алюминия
| Трифторид алюминия | |
|---|---|
   | |
| Общие | |
| Традиционные названия | трифторид алюминия, фторид алюминия, алюминия трифторид |
| Хим. формула | AlF3 |
| Физические свойства | |
| Состояние | белое твердое кристаллическое вещество без запаха |
| Молярная масса |
(ангидрид) 83.9767 (моногидрат) 101.022 (тригидрат) 138.023 г/моль |
| Плотность | 2,88 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1291 °C |
| Мол. теплоёмк. | 75,10 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1510 кДж/моль |
| Удельная теплота испарения | (возгонка) 272 Дж/кг |
| Химические свойства | |
| Растворимость | |
| • в воде |
(при 0 °C) 0.56 (при 20 °C) 0.67 (при 100 °C) 1.72 г/100 мл |
| Структура | |
| Кристаллическая структура | ромбоэдрическая |
| Классификация | |
| Рег. номер CAS |
7784-18-1 (ангидрид), 32287-65-3 (моногидрат) 15098-87-0 (тригидрат) |
| Рег. номер EINECS | 232-051-1 (ангидрид) |
| RTECS | BD0725000 |
| Безопасность | |
| Предельная концентрация | 2 мг/м3 |
| ЛД50 | 100 мг/кг (крысы, орально) |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторид алюминия — неорганическое бинарное соединение алюминия и фтора. Химическая формула AlF3.
Физические свойства
Фторид алюминия представляет собой бесцветное или белое кристаллическое вещество. При сильном нагревании возгоняется без разложения. При обычных условиях устойчива α-модификация с тригональной решеткой (а = 0,5039 нм, α = 58,50°, z = 2, пространственная группа R32), плотность 2,882 г/см³. При нагревании до ~700 °C переходит в γ-модификацию с тетрагональной решеткой (а = 0,354 нм, с = 0,600 нм).
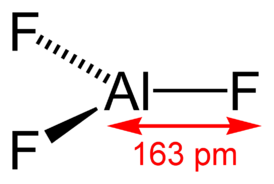
Длина связи Al—F составляет 0,163 нм. В газовой фазе, при температуре около 1000 °C, трифторид алюминия существует в виде молекул тригональной симметрии D3h.
Фторид алюминия плохо растворим в воде (0,41 % по массе при 25 °C), лучше — в растворах HF, не растворим в органических растворителях.
Получение
Взаимодействием Аl2О3 или Аl(ОН)3 с раствором HF с последующим выделением, сушкой и прокаливанием при 500-600 °C образовавшегося кристаллогидрата AlF3·3H2O:
- [math]\displaystyle{ \mathsf{Al(OH)_3+HF \rightarrow AlF_3\cdot 3H_2O \xrightarrow{500^oC} AlF_3 + 3H_2O} }[/math]
Действием на Аl2О3 газообразного HF при 450-600 °C:
- [math]\displaystyle{ \mathsf{Al_2O_3+6HF \xrightarrow{450-600^oC} 2AlF_3+3H_2O} }[/math]
По реакции:
- [math]\displaystyle{ \mathsf{2Al(OH)_3 + H_2SiF_6 \xrightarrow{H_2O} 2AlF_3\cdot 3H_2O + SiO_2\cdot nH_2O} }[/math]
с последующем выделением, сушкой и прокаливанием гидрата.
При температуре в 700 °C гексафторсиликат натрия с алюминием дают на выходе чистый кремний, гексафторалюминат натрия и трифторид алюминия:
- [math]\displaystyle{ \mathsf{3Na_2[SiF_6]+4Al \xrightarrow{700^oC} \ 3Si+2Na_3[AlF_6]+2AlF_3} }[/math]
Самым легким путём получения трифторида алюминия является прямой контакт фтора с алюминием при температуре 600 °C:
- [math]\displaystyle{ \mathsf{2Al+3F_2 \xrightarrow{600^oC} 2AlF_3} }[/math]
Нагрев до температуры примерно 175 °C моногидрат трифторида алюминия получим воду и трифторид алюминия:
- [math]\displaystyle{ \mathsf{AlF_3\cdot H_2O \xrightarrow{175^oC} AlF_3+H_2O} }[/math]
Для получения чистого безводного трифторида алюминия нужно гексафторалюминат аммония нагреть и получится трифторид алюминия с фторидом аммония:
- [math]\displaystyle{ \mathsf{(NH_4)_3AlF_6 \longrightarrow AlF_3+3NH_4F} }[/math]
В основном трифторид алюминия получают при обработке оксида алюминия гексафторсиликоновой кислотой, где на выходе получается оксид кремния(IV), трифторид алюминия и вода:
- [math]\displaystyle{ \mathsf{H_2SiF_6 + Al_2O_3 \longrightarrow 2AlF_3 + SiO_2 + H_2O} }[/math]
Кроме того, он изготавливается путём термического разложения аммония гексафторалюмината.
Химические свойства
Образует кристаллогидраты с 1, 3 и 9 молекулами воды, которые легко разрушаются при нагревании:
- [math]\displaystyle{ \mathsf{AlF_3 \cdot H_2O \xrightarrow{150-200^oC} AlF_3 + H_2O} }[/math]
При нагревании гидролизуется парами воды:
- [math]\displaystyle{ \mathsf{AlF_3 + 3H_2O \xrightarrow{400^oC} Al(OH)_3 + 3HF} }[/math]
Медленно взаимодействует с концентрированной серной кислотой H2SO4:
- [math]\displaystyle{ \mathsf{2AlF_3 + 3H_2SO_4 \xrightarrow{} Al_2(SO_4)_3 + 6HF} }[/math]
Разлагается растворами и расплавами щелочей.
- [math]\displaystyle{ \mathsf{AlF_3 + 3(NH_3\cdot H_2O) \xrightarrow{} Al(OH)_3 + 3NH_4F} }[/math]
- [math]\displaystyle{ \mathsf{4AlF_3 + 4NaOH \xrightarrow{} Na[Al(OH)_4] + 3Na[AlF_4]} }[/math]
С фторидами щелочных металлов AlF3 образует фтороалюминаты, например, гексафтороалюминат натрия Na3[AlF6]:
- [math]\displaystyle{ \mathsf{AlF_3 + 3NaF \xrightarrow{} Na_3[AlF_6]} }[/math]
Применение
- Трифторид алюминия используется как компонент электролита (примерно 5-15 %) при электролитическом производстве алюминия. Совместно с другими применяемыми добавками в электролит (фторид кальция, фторид магния, фторид лития), он уменьшает температуру плавления электролита до 930-950 °C и повышает эффективность процесса электролиза (увеличивается выход по току, уменьшается удельный расход электроэнергии).
- Входит в состав флюсов, эмалей, стекол, глазурей, керамики, покрытий сварочных электродов; является катализатором в органическом синтезе.
- Как антисептик для предотвращения брожения;
- В производстве киноплёнки.
Токсичность
Фторид алюминия ядовит, при контакте с кожей вызывает ожоги. Обладает нейротоксичностью. Смертельная доза (ЛД50) для крыс орально составляет 100 мг/кг.
В статье не хватает ссылок на источники (см. также рекомендации по поиску). |
