Нитрид алюминия
| Нитрид алюминия | |
|---|---|
 Al3+ N3− Al3+ N3− | |
 | |
| Общие | |
| Систематическое наименование |
нитрид алюминия |
| Хим. формула | AlN |
| Физические свойства | |
| Состояние | порошок от белого до светло-жёлтого цвета |
| Молярная масса | 40,9882 г/моль |
| Плотность | 3,260 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2200 °C |
| • кипения | 2517 °C |
| Уд. теплоёмк. | 740 Дж/(кг·К) |
| Теплопроводность | 285 Вт/(м·K) |
| Химические свойства | |
| Растворимость | |
| • в воде | разлагается |
| Оптические свойства | |
| Показатель преломления | 1,9–2,2 |
| Структура | |
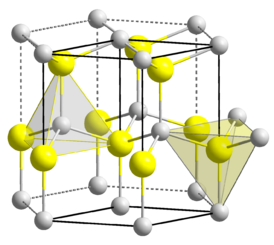
| Координационная геометрия | тетраэдральная |
| Кристаллическая структура | типа вюрцита |
| Классификация | |
| Рег. номер CAS | 24304-00-5 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитри́д алюми́ния (алюмонитри́д) — бинарное неорганическое химическое соединение алюминия с азотом. Химическая формула — AlN.
История
Нитрид алюминия был впервые синтезирован в 1877 году, но только в середине 1980-х его важность для практического применения в микроэлектронике был оценён из-за его относительно высокой для керамических материалов теплопроводности (70—210 Вт·м−1·K−1 — для поликристаллического материала, и до 275 Вт·м−1·K−1 — для монокристаллов). Этот материал представляет интерес как нетоксичная альтернатива оксиду бериллия. Методы металлизации позволяют применять соединение в электронике вместо глинозёма и оксида бериллия.
Физические свойства
Нитрид алюминия — материал с ковалентными связями, имеющий гексагональную кристаллическую структуру типа вюрцита. Кристаллографическая группа для этой структуры — [math]\displaystyle{ \mathsf{C_{6v}^4-P6_3mc} }[/math].
Химические свойства
Белый порошок или бесцветные прозрачные кристаллы. Медленно растворяется в горячих минеральных кислотах. Холодные НCl, H2SО4, HNO3 и царская водка действуют слабо, холодная HF не действует.
Концентрированные горячие растворы щелочей разлагают с выделением NH3. Вещество устойчиво к высоким температурам в инертных атмосферах.
На воздухе поверхностное окисление происходит выше 700 °C, и при комнатной температуре были обнаружены поверхностные окисленные слои толщиной 5—10 нм. Этот окисный слой оксида алюминия защищает от окисления до 1370 °C. Выше этой температуры происходит объёмное окисление материала.
Нитрид алюминия устойчив в атмосферах водорода и углекислого газа до 980 °C. Вещество медленно реагирует с неорганическими кислотами на границах кристаллических зёрен, также с сильными щелочами. Медленно гидролизуется в воде.
Применение
Относится к классу неоксидной керамики.
- Производство светодиодов (полупроводник с шириной запрещённой зоны 6 эВ).
- Материалы из нановолокна[источник не указан 1455 дней].
- Материал для керамики с высокой теплопроводностью (вместо токсичного оксида бериллия) — для подложек полупроводниковых компонентов.
Получение
Восстановлением Аl2О3 углём в атмосфере азота:
- [math]\displaystyle{ \mathsf{Al_2O_3+3C+N_2 \ \xrightarrow{1600-1800^\circ C} \ 2AlN + 3CO\!\uparrow}. }[/math]
Также нитрид алюминия можно получить с помощью азотирования (без доступа кислорода) с порошком алюминия:
- [math]\displaystyle{ \mathsf{N_2+2Al \ \xrightarrow{800-1200^\circ C} \ 2AlN} }[/math]
Пропусканием через расплавленный алюминий аммиак:
- [math]\displaystyle{ \mathsf{2Al+2NH_3 \ \xrightarrow{t\gt 600^\circ C} \ 2AlN+3H_2\!\uparrow} }[/math]
Ссылки
- Библиография 1995—1996 годов. Исследования применений нитрида алюминия Архивная копия от 29 мая 2007 на Wayback Machine