Фторид кобальта(II)
| Фторид кобальта(II) | |
|---|---|
  | |
| Систематическое название | Фторид кобальта(II) |
| Другие названия | Дифторид кобальта |
| Химическая формула | CoF2 |
| Внешний вид | розовато-красные кристаллы |
| Свойства | |
| Молярная масса |
безводный: 96,93 г/моль тетрагидрат: 168,99 г/моль |
| Температура плавления | 1127 °C (1400,15 К) |
| Температура кипения | 1740 °C (2013,15 К) |
| Плотность |
безводный: 4,46 г/см³ тетрагидрат: 2,19 г/см³ |
| Растворимость в воде | 1,5 г/100 мл |
| Токсикологические данные | |
| LD50 | 150 мг/кг |
| Структура | |
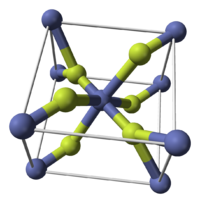
| Кристаллическая решётка | тетрагональная |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −665,7 кДж/моль |
| Стандартная молярная энтропия | +82 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −621 кДж/моль |
| Классификация | |
| Регистрационный номер CAS |
10026-17-2 (безводный) 13817-37-3 (тетрагидрат) |
| Регистрационный номер EC | 233-061-9 |
| Безопасность | |
| R-фразы | R25; R34 |
| S-фразы | S26; S36/37/39; S45 |
| H-фразы | H301; H314 |
| P-фразы | P280; P301 + P310; P305 + P351 + P338; P310 |
| Пиктограммы опасности |
|
| Пиктограммы опасности СГС |
|
| NFPA 704 | |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |

Фтори́д ко́бальта(II) (дифтори́д ко́бальта) — неорганическое вещество с химической формулой CoF2, соединение кобальта и фтора. Относится к классу бинарных соединений, соль кобальта и фтороводородной кислоты. Кристаллическое вещество красно-розового цвета.
Физические свойства
Фторид кобальта(II) при нормальных условиях — твёрдое вещество розово-красного цвета, растворимое в воде (14,5 г/л при 25 °C), нерастворимое в этаноле. Плавится и кипит без разложения.[1][2] Имеет тетрагональную сингонию кристаллической решётки, пространственная группа P42/mnm, а = 0,46951 нм, с = 0,3179 нм, Z = 2.[3]
При кристаллизации из водного раствора образует кристаллогидраты состава CoF2·4H2O и CoF2·2H2O. При осаждении из фтороводородной кислоты образует кристаллогидрат состава CoF2·5HF·6H2O.[1][3]
Тетрагидрат фторида кобальта(II) разлагается, теряя кристаллизационную воду, при 300 °C.[2]
Химические свойства
Фторид кобальта(II) вступает в следующие химические реакции.[1]
- Реагирует с горячей концентрированной серной кислотой с образованием сульфата кобальта(II) и газообразного фтороводорода:
- [math]\displaystyle{ \mathsf{CoF_2\ +\ H_2SO_4\ \longrightarrow\ CoSO_4\ +\ 2HF \uparrow} }[/math]
- Реагирует с концентрированным раствором (40 %) гидроксида натрия с образованием осадка тетрагидроксокобальтата(II) натрия:
- [math]\displaystyle{ \mathsf{CoF_2\ +\ 4NaOH\ \longrightarrow\ Na_2[Co(OH)_4] \downarrow\ +\ 2NaF} }[/math]
- С концентрированным гидратом аммиака образует комплексную соль — фторид гексаамминокобальта(II):
- [math]\displaystyle{ \mathsf{CoF_2\ +\ 6(NH_3 \cdot H_2O)\ \longrightarrow\ [Co(NH_3)_6]F_2\ +\ 6H_2O} }[/math]
- При длительном кипячении водного раствора разлагается с образованием осадка гидроксофторида кобальта(II) и фтороводорода:
- [math]\displaystyle{ \mathsf{CoF_2\ +\ H_2O\ \longrightarrow\ Co(OH)F \downarrow\ +\ HF \uparrow} }[/math]
- Реагирует с водяным паром с образованием оксида кобальта(II):
- [math]\displaystyle{ \mathsf{CoF_2\ +\ H_2O\ \xrightarrow{700\ ^\circ C}\ CoO\ +\ 2HF} }[/math]
- Реагирует с расплавами фторида натрия и фторида калия с образованием ряда фторокомплексов:
- [math]\displaystyle{ \mathsf{CoF_2\ \xrightarrow{MF}\ M[CoF_3],\ M_2[CoF_4],\ M_4[CoF_6]\ (M\ =\ Na,\ K)} }[/math]
- При нагревании в токе фтора окисляется до фторида кобальта(III):
- [math]\displaystyle{ \mathsf{2CoF_2\ +\ F_2\ \xrightarrow{75-200\ ^\circ C}\ 2CoF_3} }[/math]
- Окисляется концентрированным пероксидом водорода в присутствии карбоната натрия с образованием зелёного осадка трикарбонатокобальтата(III) натрия:
- [math]\displaystyle{ \mathsf{2CoF_2\ +\ H_2O_2\ +\ 6Na_2CO_3\ \longrightarrow\ } }[/math]
- [math]\displaystyle{ \mathsf{ \longrightarrow\ 2Na_3[Co(CO_3)_3] \downarrow\ +\ 2NaOH\ +\ 4NaF} }[/math]
- При электролизе раствора фторида кобальта(II) в концентрированной фтороводородной кислоте на аноде образуется осадок 3,5-гидрата фторида кобальта(III):
- [math]\displaystyle{ \mathsf{2CoF_2\ +\ 2HF\ +\ 7H_2O\ \xrightarrow{0-10\ ^\circ C}\ 2(CoF_3 \cdot 3,5H_2O) \downarrow} }[/math] (анод) [math]\displaystyle{ \mathsf{\ +\ H_2 \uparrow} }[/math] (катод)
Получение
Фторид кобальта(II) может быть получен следующими способами.[1]
- Нагреванием хлорида кобальта(II) или оксида кобальта(II) в токе фтороводорода:
- [math]\displaystyle{ \mathsf{CoCl_2\ +\ 2HF\ \xrightarrow{300\ ^\circ C}\ CoF_2\ +\ 2HCl} }[/math]
- [math]\displaystyle{ \mathsf{CoO\ +\ 2HF\ \xrightarrow{300-400\ ^\circ C}\ CoF_2\ +\ H_2O} }[/math]
- [math]\displaystyle{ \mathsf{Co\ +\ F_2\ \xrightarrow{200-300\ ^\circ C}\ CoF_2} }[/math]
- Термическим разложением фторида кобальта(III):
- [math]\displaystyle{ \mathsf{2CoF_3\ \xrightarrow{350-700\ ^\circ C}\ 2CoF_2\ +\ F_2} }[/math]
Также фторид кобальта(II) может быть получен:[3]
- путём термического разложения трифторокобальтата(II) аммония (NH4CoF3);
- осаждением из водных растворов солей кобальта(II) фтороводородной кислотой.
Применение
Фторид кобальта(II) является промежуточным продуктом при получении фторида кобальта(III), комплексных фторидов кобальта(III) и кобальта(IV). Применяется в производстве катодов для химических источников тока, как компонент лазерных материалов, как катализатор в производстве фторуглеводородов.[3]
Токсическое действие
Фторид кобальта(II) является очень токсичным веществом в больших количествах — LD50 для крыс перорально составляет 150 мг/кг. При контакте вызывает ожоги кожи и глаз, при проглатывании вызывает ожоги ЖКТ. При вдыхании оказывает крайне разрушительное воздействие на слизистые оболочки и верхние дыхательные пути. В высоких концентрациях дифторид кобальта является сильнейшим канцерогеном.
Примечания
- ↑ 1,0 1,1 1,2 1,3 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 112—113. — 637 с. — ISBN 978-5-358-01303-2.
- ↑ 2,0 2,1 Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 96, 459, 620. — 685 с. — ISBN 5-7107-8085-5.
- ↑ 3,0 3,1 3,2 3,3 [www.xumuk.ru/encyklopedia/2028.html Галогениды кобальта на xumuk.ru].
