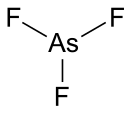
Трифторид мышьяка
Внешний вид
| Трифторид мышьяка | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Трифторид мышьяка | ||
| Традиционные названия | Трифторид мышьяка, трёхфтористый мышьяк | ||
| Хим. формула | AsF3 | ||
| Рац. формула | AsF3[1] | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость с неприятным запахом | ||
| Молярная масса | 131,92 г/моль | ||
| Плотность | 2,660; 2,7315; 3,01 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -5,94; -5,90 °C | ||
| • кипения | 56,3; 57,8; 62,2 °C | ||
| Мол. теплоёмк. | 126,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -957 кДж/моль | ||
| Оптические свойства | |||
| Показатель преломления | 1,364 | ||
| Классификация | |||
| Рег. номер CAS | 7784-35-2 | ||
| PubChem | 24571 | ||
| SMILES |
|
||
| RTECS | CG5775000 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³[2] | ||
| ЛД50 | 12 мг/кг[3] | ||
| Токсичность | При длительном контакте вызывает поражение ЦНС | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Трифтори́д мышьякá — бинарное неорганическое соединение мышьяка и фтора с формулой AsF3, бесцветная токсичная жидкость с неприятным запахом, разлагается в воде.
Получение
- Действием фтористого водорода на триоксид мышьяка:
- [math]\displaystyle{ \mathsf{As_2O_3 + 6HF \ \xrightarrow{140-200^oC}\ AsF_3 + 3H_2O } }[/math]
- Действием фторсульфоновой кислоты на триоксид мышьяка:
- [math]\displaystyle{ \mathsf{As_2O_3 + 4HSO_3F \ \xrightarrow{55-65^oC}\ AsF_3 + SO_3 + HF + As(HSO_4)_3 } }[/math]
Физические свойства
Трифторид мышьяка — бесцветная подвижная жидкость, дымит на воздухе, разлагается водой.
Растворяется в этаноле, диэтиловом эфире, бензоле.
Химические свойства
- Реагирует с водой:
- [math]\displaystyle{ \mathsf{2AsF_3 + 3H_2O \ \xrightarrow{}\ As_2O_3\downarrow + 6HF } }[/math]
- Окисляется концентрированной азотной кислотой:
- [math]\displaystyle{ \mathsf{AsF_3 + 2HNO_3 + 2H_2O \ \xrightarrow{}\ H_3AsO_4 + 3HF + 2NO_2 } }[/math]
- Реагирует с щелочами с образованием гидроарсенита натрия:
- [math]\displaystyle{ \mathsf{AsF_3 + 5NaOH \ \xrightarrow{}\ Na_2HAsO_4 + 3NaF + 2H_2O } }[/math]
- Реагирует с оксидом кремния (разъедает стекло):
- [math]\displaystyle{ \mathsf{4AsF_3 + 3SiO_2 \ \xrightarrow{100-150^oC}\ 2As_2O_3 + 3SiF_4 } }[/math]
- С фторидами щелочных металлов образует комплексные соли:
- [math]\displaystyle{ \mathsf{AsF_3 + 5KF \ \xrightarrow{}\ K[AsF_4] } }[/math]
Применение
Токсичность
Как мышьяксодержащее вещество, фторид мышьяка(III) явно ядовит.
Примечания
- ↑ name=https://docs.cntd.ru_Arsenic trifluoride
- ↑ name=https://docs.cntd.ru_ГОСТ 12.1.005. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ↑ name=https://docs.cntd.ru_ГОСТ 12.1.007. ССБТ. Вредные вещества. Классификация и общие требования безопасности
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.