RANKL
TNFSF11, или RANKL (от англ. Tumor necrosis factor ligand superfamily member 11; Receptor activator of nuclear factor kappa-B ligand) — мембранный белок, цитокин семейства факторов некроза опухоли. Продукт гена человека TNFSF11. Играет важную роль в метаболизме костной ткани, активируя остеокласты.
Функции
TNFSF11 (обозначается также RANKL) входит в многочисленное семейство факторов некроза опухоли (TNF). Является лигандом для рецепторов TNFRSF11B (остеопротегерин) и TNFRSF11A (RANK). Является ключевым фактором дифференцировки и активации остеокластов, клеток, которые обеспечивают резорбцию костной ткани. Кроме этого, RANKL играет роль в иммунной системе. Белок экспрессируется на Т-хелперах и вовлечён в созревание и выживание дендритных клеток. Активация Т-лимфоцитов приводит к индукции экспрессии цитокина, повышению остеокластогенеза и потере костной ткани. Кроме этого, RANKL активирует анти-апоптозную киназу AKT/PKB через комплекс Src-киназы и фактора TRAF6 и, таким образом, может играть роль в регуляции апоптоза.[1]
Структура
Белок состоит из 317 аминокислот, молекулярная масса — 35,5 кДа. Содержит небольшой N-концевой внутриклеточный домен, единственный трансмембранный участок и внеклеточный домен.
Является гомотримером. Является мембранным белком, но может высвобождаться в свободном виде после гидролиза участка 139—140 под действием протеазы ADAM17. При этом образуется белок из 178 аминокислот.
Взаимодействует с рецептором TNFRSF11B.
Тканевая экспрессия
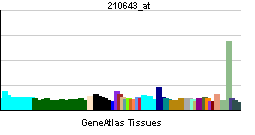
Наивысшая экспрессия наблюдается в периферических лимфатических узлах, низкий уровень - в селезёнке, периферических лимфоцитах крови, костном мозге, сердце, плаценте, скелетных мышцах, желудке и щитовидной железе.
Роль в патологии
Избыточное продукция RANKL связана с рядом дегенеративных заболеваний, включая ревматоидный артрит и псориатический артрит.
Мутации гена TNFSF11 вызывают аутосомный рецессивный остеопетроз 2-го типа, нарушение костной ткани, характеризующееся повышенной плотностью из-за замедленной ресорбции незрелых костей.
См. также
Примечания
Литература
- Whyte M. The long and the short of bone therapy (англ.) // N Engl J Med : journal. — 2006. — Vol. 354, no. 8. — P. 860—863. — doi:10.1056/NEJMe068003. — PMID 16495400. link Архивная копия от 5 января 2010 на Wayback Machine
- Buckley K.A., Fraser W.D. Receptor activator for nuclear factor kappaB ligand and osteoprotegerin: regulators of bone physiology and immune responses/potential therapeutic agents and biochemical markers. (англ.) // Ann. Clin. Biochem.[англ.] : journal. — 2003. — Vol. 39, no. Pt 6. — P. 551—556. — doi:10.1258/000456302760413324. — PMID 12564836.
- Jeffcoate W. Vascular calcification and osteolysis in diabetic neuropathy-is RANK-L the missing link? (англ.) // Diabetologia[англ.] : journal. — 2005. — Vol. 47, no. 9. — P. 1488—1492. — doi:10.1007/s00125-004-1477-5. — PMID 15322748.
- Collin-Osdoby P. Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin. (англ.) // Circ. Res.[англ.] : journal. — 2005. — Vol. 95, no. 11. — P. 1046—1057. — doi:10.1161/01.RES.0000149165.99974.12. — PMID 15564564.
- Whyte M.P., Mumm S. Heritable disorders of the RANKL/OPG/RANK signaling pathway. (англ.) // Journal of musculoskeletal & neuronal interactions : journal. — 2005. — Vol. 4, no. 3. — P. 254—267. — PMID 15615493.
- Clohisy D.R., Mantyh P.W. Bone cancer pain and the role of RANKL/OPG. (неопр.) // Journal of musculoskeletal & neuronal interactions. — 2005. — Т. 4, № 3. — С. 293—300. — PMID 15615497.
- Anandarajah A.P., Schwarz E.M. Anti-RANKL therapy for inflammatory bone disorders: Mechanisms and potential clinical applications. (англ.) // J. Cell. Biochem.[англ.] : journal. — 2006. — Vol. 97, no. 2. — P. 226—232. — doi:10.1002/jcb.20674. — PMID 16240334.
- Baud'huin M., Duplomb L., Ruiz Velasco C., et al. Key roles of the OPG-RANK-RANKL system in bone oncology. (англ.) // Expert Rev Anticancer Ther[англ.] : journal. — 2007. — Vol. 7, no. 2. — P. 221—232. — doi:10.1586/14737140.7.2.221. — PMID 17288531.
- Yogo K., Ishida-Kitagawa N., Takeya T. Negative autoregulation of RANKL and c-Src signaling in osteoclasts. (англ.) // J. Bone Miner. Metab. : journal. — 2007. — Vol. 25, no. 4. — P. 205—210. — doi:10.1007/s00774-007-0751-2. — PMID 17593489.
- Boyce B.F., Xing L. Biology of RANK, RANKL, and osteoprotegerin. (англ.) // Arthritis Res. Ther.[англ.] : journal. — 2007. — Vol. 9 Suppl 1. — P. S1. — doi:10.1186/ar2165. — PMID 17634140.
- McClung M. Role of RANKL inhibition in osteoporosis. (англ.) // Arthritis Res. Ther.[англ.] : journal. — 2007. — Vol. 9 Suppl 1. — P. S3. — doi:10.1186/ar2167. — PMID 17634142.