Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая |
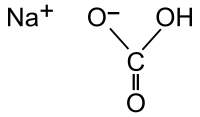
| Рац. формула | NaHCO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 60—200 °C |
| Энтальпия | |
| • образования | -947,7 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 9,59 г/100 мл |
| Классификация | |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| SMILES | |
| Безопасность | |
| ЛД50 | 4220 мг/кг |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas), другие названия: бикарбона́т на́трия, питьева́я или пищева́я со́да, двууглеки́слый на́трий — неорганическое вещество, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
В природе встречается в виде минерала нахколита.
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли, соответствующей данной кислоте (например, с соляной кислотой — хлорида натрия, с серной — сульфата натрия), и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется в виде пузырьков:
- [math]\displaystyle{ \mathsf{NaHCO_3 + HCl \rightarrow NaCl + H_2CO_3}, }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 \rightarrow H_2O + CO_2\uparrow}, }[/math]
- [math]\displaystyle{ \mathsf{2NaHCO_3 + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O+2CO_2\uparrow}. }[/math]
В быту иногда применяется реакция «гашения соды» уксусной кислотой с образованием ацетата натрия или гашение лимонной кислотой с образованием цитрата натрия. Реакция с уксусной кислотой:
- [math]\displaystyle{ \mathsf{NaHCO_3 + CH_3COOH \rightarrow CH_3COONa + H_2O + CO_2\uparrow}. }[/math]
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C:
- [math]\displaystyle{ \mathsf{2NaHCO_3 \xrightarrow{60-200^\circ C} Na_2CO_3 + H_2O + CO_2\uparrow}. }[/math]
При этом процессе вследствие выделения углекислого газa и воды (в виде водяного пара) масса исходного вещества уменьшается примерно на 37 %.
Получение
В природе сода образуется в результате естественных процессов, главным образом, выпаривания воды из содовых озёр. Минералы, содержащие соду, накапливаются на дне таких озёр, образуя залежи троны, из которого и добывают пищевую соду. Озёра, богатые содой, встречаются в США, Танзании и некоторых регионах России.
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[1]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- [math]\displaystyle{ \mathsf{NH_3 + CO_2 + H_2O \rightarrow NH_4HCO_3} }[/math]
- [math]\displaystyle{ \mathsf{NH_4HCO_3 + NaCl \rightarrow NaHCO_3\downarrow + NH_4Cl}. }[/math]
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- [math]\displaystyle{ \mathsf{2NH_4Cl + Ca(OH)_2 \rightarrow 2NH_3\uparrow + CaCl_2 + 2H_2O}. }[/math]
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях. Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности
В производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности
В хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии

Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении пищевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Пероральный приём
Применяется в качестве антацидного средства. При пероральном приёме снижает кислотность желудочного сока и используется для лечения язвенной болезни желудка и двенадцатиперстной кишки[2]. Тем не менее, в результате применения может возникнуть кислотный рикошет, так как при реакции соды с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина[2].
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях[3] и полости рта и горла, при сильном кашле, ангине, фарингите[4]. При ринитах, конъюнктивитах, стоматитах, ларингитах и т. п. применяют для полосканий, промываний, ингаляций 0,5 — 2 % растворы[2].
Ингаляционное введение
Раствор ингалируется при помощи небулайзера. Усиливает секрецию слизистой трахеобронхиального дерева, тем самым увеличивая количество мокроты и делая её менее вязкой.[2] Может применятся для стимуляции выработки мокроты с целью её бактериологического исследования во фтизиатрии.
Внутривенная инфузия
Препарат выбора для быстрой коррекции метаболического ацидоза во время реанимационных мероприятий. Применяется в качестве антиаритмического средства при отравлении лекарственными средствами удлиняющими интервал QT, такими как трициклические антидепрессанты, кокаин, нейролептики.
Противопоказания
При внутривенном введении быстро повышает pH и вызывает снижение уровня калия и кальция в плазме. Соответственно противопоказан при:
- Изначально высоком pH — метаболическом алкалозе, например, вследствие гипохлоремии — снижении концентрации в крови ионов Cl-, в том числе вызванной рвотой, или снижением всасывания в желудочно-кишечном тракте,
- Респираторном ацидозе — так как выделяющийся CO2 усилит его,
- Гипокальциемии — может спровоцировать тетанические судороги[5].
Является источником натрия и повышает осмоляльность плазмы, тем самым увеличивая объём циркулирующей крови. Задержка натрия усиливает отёки и повышает артериальное давление. Таким образом, использование при артериальной гипертензии, совместно с минералокортикоидами, низконатриевой диете должно быть ограничено. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
В альтернативной медицине
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует[6].
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, который затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцово-кислотных аккумуляторов насыщенным водным раствором питьевой соды.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество малотоксично, ЛД50 4220 мг/кг (крысы, перорально)[7].
Пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3[8].
Примечания
- ↑ Глинка Н. Л. Общая химия. — М.: «Химия», 1977, переработанное. — С. 441. — 720 с.
- ↑ 2,0 2,1 2,2 2,3 Машковский М.Д. Лекарственные средства (пособие по фармокотерапии для врачей). — Медицина, 1998. — С. 112. — 688 с.
- ↑ Полоскание при зубной боли — рекомендации. Дата обращения: 29 марта 2017. Архивировано 8 мая 2017 года.
- ↑ Полоскание рта содой как средство от воспалений. Дата обращения: 29 марта 2017. Архивировано 30 марта 2017 года.
- ↑ Инструкция. Дата обращения: 31 марта 2020. Архивировано 18 января 2021 года.
- ↑ Sodium Bicarbonate (копия Archive.org) // American Cancer Society, 11/28/2008 (англ.): «Available peer-reviewed medical journals do not support claims that sodium bicarbonate works as a cancer treatment.»
- ↑ Chambers, Michael Sodium bicarbonate [USP:JAN]. ChemIDplus. U.S. National Library of Medicine. Дата обращения: 7 декабря 2020. Архивировано 20 декабря 2019 года.
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» Архивная копия от 13 января 2010 на Wayback Machine
Литература
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
