Угольная кислота
| Угольная кислота | |
|---|---|
  | |
| Систематическое название | Угольная кислота |
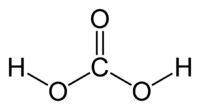
| Химическая формула | H2CO3 |
| Внешний вид | Бесцветный раствор |
| Свойства | |
| Молярная масса | 62,025 г/моль |
| Температура плавления | ? |
| Температура кипения | ? |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa |
реальные: 1) 3,60; 2) 10,33 кажущаяся[1]: 6,37 |
| Растворимость в воде | 0,21[1] г/100 мл |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 463-79-6 |
| PubChem | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Безопасность | |
| Пиктограммы опасности СГС |
|
| NFPA 704 | |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
У́гольная кислота́ (химическая формула — H2CO3) — слабая химическая неорганическая кислота. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха.
При нормальных условиях, угольная кислота неустойчива и разлагается на углекислый газ и воду. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём при нормальных условиях равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp2-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- [math]\displaystyle{ \mathsf{CO_2 \cdot H_2O_{(p)} \rightleftarrows H_2CO_{3(p)} } }[/math], константа равновесия при 25 °C [math]\displaystyle{ K_p = \frac{\mathsf{[H_2CO_3]}}{\mathsf{[CO_2 \cdot H_2O]}} = 1{,}70\cdot 10^{-3} }[/math]
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- [math]\displaystyle{ \mathsf{CO_2 \cdot H_2O_{(p)} \rightleftarrows CO_2 \uparrow +\ H_2O} }[/math]
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- [math]\displaystyle{ \mathsf{H_2CO_3 +\ H_2O \rightleftarrows HCO_3^- +\ H_3O^+} }[/math], константа кислотности при 25 °C [math]\displaystyle{ K_{a1} = \frac{\mathsf{[HCO_3^-] \cdot [H_3O^+]}}{\mathsf{[H_2CO_3]}} = 2{,}5 \cdot 10^{-4} }[/math]
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- [math]\displaystyle{ K_a' = \frac{\mathsf{[HCO_3^-] \cdot [H_3O^+]}}{\mathsf{[CO_2 \cdot H_2O]}} = 4{,}27 \cdot 10^{-7} }[/math]
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- [math]\displaystyle{ \mathsf{HCO_3^- +\ H_2O \rightleftarrows CO_3^{2-} +\ H_3O^+} }[/math], константа кислотности при 25 °C [math]\displaystyle{ K_{a2} = \frac{\mathsf{[CO_3^{2-}] \cdot [H_3O^+]}}{\mathsf{[HCO_3^-]}} = 4{,}68 \cdot 10^{-11} }[/math]
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- [math]\displaystyle{ \mathsf{CO_2 \stackrel{H_2O}{\rightleftarrows} CO_2 \cdot H_2O \rightleftarrows H_2CO_3 \stackrel{-H^+}{\rightleftarrows} HCO_3^- \stackrel{-H^+}{\rightleftarrows} CO_3^{2-} (*)} }[/math]
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- [math]\displaystyle{ \mathsf{pH =-lg \left( \frac {-K_a'+ \sqrt {(K_a')^2 + 4 K_a' C_0} }{2} \right) = 3{,}9} }[/math], где C₀ = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- [math]\displaystyle{ \mathsf{H_2CO_3 \longrightarrow H_2O + CO_2 \uparrow} }[/math]
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- [math]\displaystyle{ \mathsf{H_2CO_3 + 2 NaOH} }[/math](конц.)[math]\displaystyle{ \mathsf{\longrightarrow Na_2CO_3 + 2 H_2O} }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 + NaOH} }[/math](разб.)[math]\displaystyle{ \mathsf{\longrightarrow NaHCO_3 + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 +\ Ca(OH)_2 \longrightarrow CaCO_3 \downarrow + \ 2H_2O} }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 +\ NH_3 \cdot H_2O \longrightarrow NH_4HCO_3 + H_2O} }[/math]
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- [math]\displaystyle{ \mathsf{H_2CO_3 + Na_2CO_3 \longrightarrow 2 NaHCO_3} }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 +\ CaCO_3 \longrightarrow Ca(HCO_3)_2} }[/math]
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
- [math]\displaystyle{ \mathsf{CO_2 + H_2O \rightleftarrows CO_2 \cdot H_2O \rightleftarrows H_2CO_3} }[/math]
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- [math]\displaystyle{ \mathsf{Na_2CO_3 + 2 HCl \longrightarrow 2NaCl + H_2CO_3} }[/math]
- [math]\displaystyle{ \mathsf{H_2CO_3 \rightarrow H_2O+CO_2 \uparrow} }[/math]
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. «Газированная вода»).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.

