Оксид марганца(IV)
| Оксид марганца(IV) | |
|---|---|
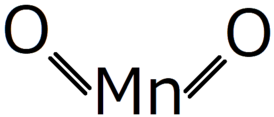  | |
 | |
| Общие | |
| Систематическое наименование |
Диоксид марганца |
| Хим. формула | MnO2 |
| Физические свойства | |
| Состояние | черные тетрагональные кристаллы |
| Молярная масса | 86,9368 г/моль |
| Плотность | 5,026 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 535 °C |
| Энтальпия | |
| • образования | -521,5 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| Классификация | |
| Рег. номер CAS | [1313-13-9] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид марганца(IV) (диоксид марганца) [math]\ce{ MnO2 }[/math] — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Химические свойства
При обычных условиях диоксид марганца ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
- [math]\ce{ 4HCl + MnO2 -> MnCl2 + Cl2 ^ + 2H2O }[/math].
С серной и азотной кислотами [math]\ce{ MnO2 }[/math] разлагается с выделением кислорода:
- [math]\ce{ 2MnO2 + 2H2SO4 -> 2MnSO4 + O2 ^ + 2H2O }[/math].
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений [math]\ce{ Mn^{+7} }[/math] и [math]\ce{ Mn^{+6} }[/math]:
- [math]\ce{ 3MnO2 + KClO3 + 6KOH -> 3K2MnO4 + KCl + 3H2O }[/math].
Диоксид марганца проявляет амфотерные свойства. Так, в концентрированных сернокислых растворах образует сульфат марганца(IV):
- [math]\ce{ MnO2 + 2H2SO4 -> Mn(SO4)2 + 2H2O }[/math].
А при сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли — манганиты:
- [math]\ce{ MnO2 + CaO -> CaMnO3 }[/math].
Является катализатором разложения пероксида водорода:
- [math]\ce{ 2H2O2 ->[\ce{MnO2}] 2H2O + O2 ^ }[/math].
При нагревании выше 530°C разлагается:
- [math]\ce{ 4MnO2->[530^\circ\text{C}] 2Mn2O3\ + O2 }[/math].
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
- [math]\ce{ 2KMnO4->[t] K2MnO4 \ + MnO2\ + O2 ^ }[/math].
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике образовавшийся [math]\ce{ MnO2 }[/math] каталитически разлагает пероксид водорода, вследствие чего реакция до конца не протекает.
- [math]\ce{ 2KMnO4 + H2O2 -> 2KOH + 2MnO2 + 2O2 ^ }[/math].
При температуре выше 100°C восстановлением перманганата калия водородом:
- [math]\ce{ 2KMnO4 + 2H2 ->[t] K2MnO4 + MnO2 + 2H2O }[/math].
Структура
Известны несколько полиморфных модификаций диоксида марганца и его гидратированных форм. Диоксид марганца, как и многие другие диоксиды, имеет кристаллическую структуру рутила (пиролюзит, или [math]\ce{ \beta - MnO_2 }[/math]), где атомы металла занимают центры октаэдров, а координационное число атомов кислорода равно трём. Для диоксида марганца характерен недостаток кислорода, его нестехиометричный состав достигается за счет вакансий в подрешетке кислорода. У α-модификации диоксида марганца очень открытая структура, содержащая «каналы», в которых могут размещаться атомы некоторых металлов, например, серебра или бария. [math]\ce{ \alpha - MnO_2 }[/math], вслед за структурно родственным минералом, часто называют голландитом.
Археология
- Красящие вещества, обнаруженные во время раскопок в пещере Ласко и образцы, взятые с некоторых наскальных изображений, соответствовали диоксиду марганца[1].
- Учёные определили, что кусочки чёрных камней из пещеры Пеш-де-Лазе на юге Франции, сложены исключительно из диоксида марганца. Возможно, неандертальцы использовали этот минерал в качестве окислителя и катализатора реакций окисления и горения[2].
Применение
- Применяется для промышленного производства марганца;
- Как деполяризатор в «батарейках» (сухих гальванических элементах);
- Компонент минеральных пигментов;
- Осветлитель стекла.
Примечания
- ↑ Chalmin E., Menu M., Pomiès M.-P., Vignaud C., Aujoulat N. et Geneste J.-M. Les blasons de Lascaux // L’Anthropologie, 2004. T. 108. Р. 571—592.
- ↑ Неандертальская химия. Дата обращения: 7 марта 2016. Архивировано 7 марта 2016 года.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Неорганическая химия под редакцией Ю. Д. Третьякова; Химия переходных элементов Кн. 1
- П. З. Пиролюзит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1898. — Т. XXIIIA (46): Петропавловский — Поватажное. — С. 653—654.
- Полианит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1906. — Т. доп. II. — С. 436.