Оксид кюрия(III)
Внешний вид
| Оксид кюрия(III) | |
|---|---|
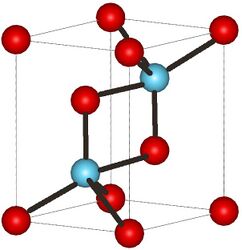 Гексагональная структура Гексагональная структура | |
| Общие | |
| Систематическое наименование |
Оксид кюрия(III) |
| Традиционные названия | Кюрия окись(III) |
| Хим. формула | Cm2O3 |
| Физические свойства | |
| Состояние | белые/рыжевато-коричневые кристаллы |
| Молярная масса | 542,16 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 2260 ± 25 °C |
| Энтальпия | |
| • образования | для моноклинной сингонии: -1684 ± 14 кДж/моль |
| Классификация | |
| PubChem | 18415183 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид кюрия(III) (триоксид кюрия, трёхокись кюрия) — бинарное неорганическое соединение кюрия и кислорода. Представляет собой кристаллы от белого до рыжевато-коричневого цвета, малорастворимые в воде.
Получение
- Термическое разложение диоксида кюрия при температуре 600 °C и давлении 10-4 мм рт. ст.[1]:
- [math]\displaystyle{ \mathsf{ 4CmO_2 \ \xrightarrow{600^oC}\ 2Cm_2O_3 + O_2\uparrow } }[/math]
- Восстановление диоксида кюрия водородом при повышенной температуре[2]:
- [math]\displaystyle{ \mathsf{ 2CmO_2 + H_2 \ \xrightarrow{t}\ Cm_2O_3 + H_2O } }[/math]
- [math]\displaystyle{ \mathsf{ 4Cm + 3O_2 \ \xrightarrow{t}\ 2Cm_2O_3 } }[/math]
- Данный способ не находит практического применения ввиду сомнительной чистоты продукта, загрязнённого диоксидом кюрия и другими соединениями этого металла нестехиометрического состава.
Физические свойства
Оксид кюрия(III) образует кристаллы нескольких модификаций:
- Кристаллы кубической сингонии. Параметр ячейки a = 1,101 нм. Оливковый цвет[2]. Изоструктурны кристаллам кубической сингонии оксида марганца(III). Пространственная группа [math]\displaystyle{ Ia3 }[/math][4]. Образуются при термическом разложении диоксида кюрия. Переходят в моноклинную форму при температуре выше 800 °C[1].
- Кристаллы моноклинной сингонии. Параметры ячейки a = 1,4282 нм, b = 0,3652 нм, c = 0,8900 нм, угол β = 100,29°[2]. Изоструктурны кристаллам моноклинной сингонии оксида лантана(III). Пространственная группа [math]\displaystyle{ C2/m }[/math][4]. Образуются при восстановлении диоксида кюрия водородом. Энтропия образования данной модификации оксида кюрия(III) оценивается в 167 ± 5 Дж/(К*моль)[1].
- Кристаллы гексагональной сингонии. Параметры ячейки a = 0,380 нм, c = 0,600 нм[2]. Изоструктурны кристаллам гексагональной сингонии оксида лантана(III). Пространственная группа [math]\displaystyle{ P\bar{3}m1 }[/math][4]. Постепенно образуются при комнатной температуре из кристаллов кубической сингонии под действием собственного излучения[1].
Исследование фазовой диаграммы металл-кислород показало большое её сходство с аналогичными системами плутония, празеодима и тербия, что указывает на возможное существование ещё двух фаз оксида кюрия(III), которые на данный момент на выделены[5].
Малорастворим в воде.
Химические свойства
- При нагревании до 650 °C в кислороде при давлении 1 атм переходит в оксид кюрия(IV)[1]:
- [math]\displaystyle{ \mathsf{ 2Cm_2O_3 + O_2 \ \xrightarrow{650^oC}\ 4CmO_2 } }[/math]
- При нагревании с оксидом алюминия образует смешанный оксид[6]:
- [math]\displaystyle{ \mathsf{ Cm_2O_3 + Al_2O_3 \ \xrightarrow{t}\ 2CmAlO_3 } }[/math]
- При обработке безводным хлороводородом при температуре 400—600 °C переходит в хлорид кюрия(III)[7]:
- [math]\displaystyle{ \mathsf{ Cm_2O_3 + 6HCl \ \xrightarrow{400-600^oC}\ 2CmCl_3 + 3H_2O\uparrow } }[/math]
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 Вейгель и др., 1997, с. 501.
- ↑ 2,0 2,1 2,2 2,3 Кнунянц и др., 1990, с. 560.
- ↑ Лидин, 2000, с. 349.
- ↑ 4,0 4,1 4,2 Вейгель и др., 1997, с. 498.
- ↑ Вейгель и др., 1997, с. 501-502.
- ↑ Вейгель и др., 1997, с. 504.
- ↑ Вейгель и др., 1997, с. 500.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 673 с. — ISBN 5-85270-035-5.
- Вейгель Ф., Кац Д., Сиборг Г. и др. Химия актиноидов. — М.: Мир, 1997. — Т. 2. — 654 с. — ISBN 5-03-001885-9.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.