Гидроксид марганца(II)
| Гидроксид марганца(II) | |
|---|---|
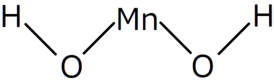 | |
| Общие | |
| Систематическое наименование |
Гидроксид марганца(II) |
| Традиционные названия | Гидроокись марганца |
| Хим. формула | Mn(OH)2 |
| Физические свойства | |
| Состояние | светло-розовые кристаллы |
| Молярная масса | 88,95 г/моль |
| Плотность | 3,258 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,0002 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,681; 1,723 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид марганца(II) — неорганическое соединение, гидроксид металла марганца с формулой Mn(OH)2, телесные кристаллы, не растворимые в воде.
Описание
Гидроксид марганца(II) — студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет средне основные свойства. Окисляется на воздухе.
Гидроксид марганца(II) образует белые кристаллы триклинной сингонии, пространственная группа P 3m1, параметры ячейки a = 0,334 нм, c = 0,468 нм, Z = 1.
Химические свойства
- Гидроксид марганца (II) легко окисляется на воздухе до бурого оксогидроксида марганца, который далее окисляется до оксида марганца (IV):
- [math]\displaystyle{ \mathsf{4Mn(OH)_2 + \ O_2 \longrightarrow \ 4MnO(OH)+\ 2H_2O} }[/math]
- [math]\displaystyle{ \mathsf{4MnO(OH)+\ O_2 \longrightarrow \ 4MnO_2 + \ 2H_2O} }[/math]
- Гидроксид марганца (II) обладает основными свойствами. Он реагирует с кислотами и кислотными оксидами:
- [math]\displaystyle{ \mathsf{Mn(OH)_2 + \ 2HCl \longrightarrow \ MnCl_2 + \ 2H_2O} }[/math]
- [math]\displaystyle{ \mathsf{Mn(OH)_2 + \ SO_3 \longrightarrow \ MnSO_4 + \ H_2O} }[/math]
- Гидроксид марганца (II) обладает восстановительными свойствами. В присутствии сильных окислителей он может окисляться до перманганата:
- [math]\displaystyle{ \mathsf{2Mn(OH)_2 + \ 5KBrO + \ 2KOH \longrightarrow \ 2KMnO_4 + \ 5KBr + \ 3H_2O} }[/math]
Получение
- Образуется гидроксид марганца (II) при взаимодействии его солей со щелочами:
- [math]\displaystyle{ \mathsf{MnSO_4 + \ 2KOH \longrightarrow \ Mn(OH)_2 + \ K_2SO_4} }[/math]
См. также
В статье не хватает ссылок на источники (см. также рекомендации по поиску). |