Оксид азота(IV)
| Оксид азота(IV) | |
|---|---|
  | |
 | |
| Общие | |
| Систематическое наименование |
Оксид азота(IV) |
| Традиционные названия | диоксид азота; двуокись азота, тетраоксид диазота |
| Хим. формула | NO2 |
| Рац. формула | NO2 |
| Физические свойства | |
| Состояние | бурый газ или желтоватая жидкость |
| Молярная масса | 46,0055 г/моль |
| Плотность |
г. 2,0527 г/л ж. 1,4910г/см³ тв. 1,536 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -11,2 °C |
| • кипения | +21,1 °C |
| • разложения | выше +500 °C |
| Энтальпия | |
| • образования | 33,10 кДж/моль |
| Классификация | |
| Рег. номер CAS | 10102-44-0 |
| Безопасность | |
| Предельная концентрация | 2 мг/м³ |
| Токсичность | Токсичен, окислитель, СДЯВ |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
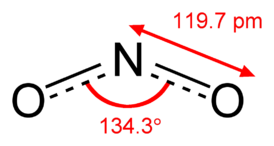
Оксид азота (IV) (диоксид азота, двуокись азота) NO2 — бинарное неорганическое соединение азота с кислородом. Представляет собой ядовитый газ красно-бурого цвета с резким неприятным запахом или желтоватую жидкость.
Димеризация молекулы

В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к образованию которого объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C диоксид азота состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислоты на медь:
[math]\displaystyle{ \mathsf{Cu + 4HNO_3\rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O} }[/math].
Также взаимодействием нитритов с серной кислотой:
[math]\displaystyle{ \mathsf{2NaNO_2 + H_2SO_4\rightarrow Na_2SO_4 + NO_2\uparrow + NO\uparrow + H_2O} }[/math],
оксид азота(II) NO тотчас же реагирует с кислородом:
[math]\displaystyle{ \mathsf{2NO + O_2\rightarrow 2NO_2\uparrow} }[/math]
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность, чтобы не допустить его взрыва:
[math]\displaystyle{ \mathsf{2Pb(NO_3)_2\rightarrow 2PbO + 4NO_2\uparrow + O_2\uparrow} }[/math]
Разработан более совершенный лабораторный способ получения NO2[1].
[math]\displaystyle{ \mathsf{CH_3COOH + 6HNO_3\rightarrow 5NO_2\uparrow + 5H_2O + NO\uparrow + 2CO_2\uparrow} }[/math]
Образующийся монооксид азота тотчас же вступает в реакцию с кислородом:
[math]\displaystyle{ \mathsf{2NO + O_2\rightarrow 2NO_2\uparrow} }[/math]
Последняя реакция была разработана и реализована в новой химической машине — генераторе окислителя ракетного топлива марки NTO согласно ГОСТ Р ИСО 15859-5-2010[2].
Другие способы получения оксида азота(IV) перечислены в статье [2].
Химические свойства
Кислотный оксид. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
[math]\displaystyle{ \mathsf{2NO_2 + 2C \rightarrow 2CO_2\uparrow + N_2\uparrow} }[/math]
[math]\displaystyle{ \mathsf{10NO_2 + 8P \rightarrow 4P_2O_5 + 5N_2\uparrow} }[/math]
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
[math]\displaystyle{ \mathsf{SO_2 + NO_2 \rightarrow SO_3 + NO\uparrow} }[/math]
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
[math]\displaystyle{ \mathsf{2NO_2 + H_2O \rightarrow HNO_3 + HNO_2} }[/math]
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
[math]\displaystyle{ \mathsf{3NO_2 + H_2O \rightarrow 2HNO_3 + NO \uparrow} }[/math]
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
[math]\displaystyle{ \mathsf{4NO_2 + 2H_2O + O_2 \rightarrow 4HNO_3} }[/math]
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
[math]\displaystyle{ \mathsf{2NO_2 + 2KOH \rightarrow KNO_3 + KNO_2 + H_2O} }[/math]
Жидкий NO2 применяется для получения безводных нитратов:
[math]\displaystyle{ \mathsf{Zn + 2N_2O_4 \rightarrow Zn(NO_3)_2 + 2NO\uparrow} }[/math]
В реакциях с галогенами образует соли нитрония, нитрозила и оксиды галогенов:
[math]\displaystyle{ \mathsf{2NO_2 + 2Cl_2 \rightarrow NOCl\uparrow + NO_2Cl\uparrow + Cl_2O \uparrow} }[/math]
Применение
Диоксид азота применяется при производстве серной и азотной кислот. Также диоксид азота используется в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие и токсичность



Оксид азота (IV) (диоксид азота) особо токсичен, является мощным окислителем. Числится в списке сильнодействующих ядовитых веществ. В больших дозах может стать сильнейшим неорганическим ядом. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»

«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота (NOx) на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и лёгкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
Примечания
- ↑ EA201700017A1 20180430. Дата обращения: 17 марта 2022. Архивировано 9 июля 2020 года.
- ↑ ГОСТ Р ИСО 15859-5-2010 Системы космические. Характеристики, отбор проб и методы анализа текучих сред. Часть 5. Ракетное топливо на основе тетроксида азота. Дата обращения: 22 ноября 2018. Архивировано 22 ноября 2018 года.
Литература
- 1. Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- 2. A New Method of Nitrogen Dioxide Production / D.A. Rudakov / June 2018. doi: 10.13140/RG.2.2.19010.27844 (https://www.researchgate.net/publication/325846942_A_New_Method_of_Nitrogen_Dioxide_Production Архивная копия от 23 ноября 2018 на Wayback Machine)
| Оксиды |
|---|
