Галогеналканы


Галогеноалканы (алкилгалогениды) — органические соединения, которые содержат в своём составе связь «углерод-галоген». Их строение можно представить, исходя из строения углеводорода, в котором связь С-Н заменена на связь С-Х, (Х — фтор, хлор, бром, иод). В силу того, что атомы галогенов являются более электроотрицательными, чем атом углерода, связь С-Х поляризована таким образом, что атом галогена приобретает частичный отрицательный заряд, а атом углерода — частичный положительный. Соответственно, алкилгалогениды являются ярко выраженными электрофилами, и на этом свойстве основано их применение в органическом синтезе.
Номенклатура
Согласно рекомендациям ИЮПАК, галогеналканы следует называть по заместительной либо радикало-функциональной номенклатуре. В заместительной номенклатуре атомы галогенов обозначаются приставками «фтор-», «хлор-», «бром-» или «иод-», которые добавляются к названию родоначального углеводорода с указанием перед ними локанта — номера атома углерода, с которым связан галоген. Например, вещество CH3-CHBr-CH2-CH3 будет называться «2-бромбутан». При наличии в составе молекулы нескольких атомов одного и того же галогена необходимо указать все локанты, а также использовать соответствующие множащие приставки: «ди-», «три-», «тетра-» и т. д. Так, Br-CH2-CH2-Br называется «1,2-дибромэтан»[1].
Название соединения по радикало-функциональной номенклатуре составляется из названия органического радикала и класса соединения («фторид», «хлорид», «бромид», «иодид») с использованием, если необходимо, множащих приставок. Например, CH3-CHBr-CH2-CH3 — втор-бутилбромид; Br-CH2-CH2-Br — этилендибромид. Эта номенклатура, как правило, применяется для простых галогеналканов, в составе которых содержится один атом галогена[1].
Традиционно в русском языке используется также другой вариант радикало-функциональной номенклатуры, в котором класс галогеналкана выражается в виде прилагательных «фтористый», «хлористый», «бромистый», «иодистый». Например, метилиодид — иодистый метил, изопропилхлорид — хлористый изопропил[2].
В рамках номенклатуры ИЮПАК сохраняются некоторые тривиальные названия галогеналканов: хлороформ CHCl3, бромоформ CHBr3 и иодоформ CHI3[1]. Полностью галогенированные алканы, в которых на галоген замещены все атомы водорода, называются пергалогенированными[2].
Галогеналканы делятся по признаку строения углеводородного радикала, к которому присоединён атом галогена. Выделяют первичные (RCH2X), вторичные (R2CHX) и третичные галогениды (R3CX)[2].
Строение и физические свойства
Строение молекул
| Молекула | Электроотрицательность галогена |
Длина связи C—X, Å |
Дипольный момент, D |
|---|---|---|---|
| CH3F | 4,0 | 1,39 | 1,85 |
| CH3Cl | 3,0 | 1,78 | 1,87 |
| CH3Br | 2,8 | 1,93 | 1,81 |
| CH3I | 2,5 | 2,14 | 1,62 |
Галогены являются электроотрицательными элементами, поэтому введение их в молекулы приводит к возникновению полярных связей типа C—X, где X — атом галогена. Такое смещение электронной плотности называют отрицательным индуктивным эффектом галогена; на атоме углерода возникает частичный положительный заряд, а на атоме галогена — частичный отрицательный заряд. Наиболее полярной является связь со фтором (как наиболее электроотрицательным галогеном), а наименее полярной — с иодом. Количественно полярность связи выражается при помощи величины дипольного момента, который учитывает частичные заряды на атомах и расстояние между этими зарядами (то есть длину связи). Поскольку эти два компонента изменяются в противоположных направлениях, дипольный момент в ряду связей C—X изменяется неравномерно[3].
Из связей типа C—X только связь С—F (464 кДж/моль) прочнее связи C—H (414 кДж/моль). Энергия связи уменьшается при увеличении радиуса галогена и длины связи: C—Cl (355 кДж/моль), C—Br (309 кДж/моль), C—I (228 кДж/моль)[4].
Физические свойства
Галогеналканы, в основном, бесцветны, хотя иодиды на свету могут в небольшой степени разлагаться и приобретать красную или коричневую окраску из-за выделяющегося иода. Низшие галогениды имеют сладковатый запах[2].
Галогеналканы почти не растворяются в воде, но смешиваются со многими органическими растворителями[2].
Температура кипения галогеналканов отражает силу их межмолекулярного взаимодействия в жидком состоянии. Обеспечивают межмолекулярное взаимодействие преимущественно силы Ван-дер-Ваальса. При рассмотрении температуры кипения различных галогеналканов можно заметить следующие зависимости:
- Разветвлённые изомеры имеют более низкую температуру кипения, чем линейные (н-бутилбромид — 100 °С, трет-бутилбромид — 72 °С). Причина заключается в том, что разветвлённые соединения имеют более сферическую форму и меньшую площадь поверхности. Из-за этого силы Ван-дер-Ваальса проявляются слабее.
- Если сравнивать алкан и галогеналкан сходной структуры и молекулярной массы, то температура кипения галогеналкана будет выше (этан — −89 °С, бромметан — 4 °С). Это связано с полярностью галогенида и большей поляризуемостью брома по сравнению с метилом.
- Температуры кипения фторалканов близки к температурам кипения алканов соответствующей молекулярной массы (н-гексан — 69 °С, 1-фторпентан — 63 °С). Это связано с небольшим размером фтора и его низкой поляризуемостью[5].
Плотность жидких галогеналканов выше, чем плотность алканов соответствующей молекулярной массы. Это объясняется тем, что галогены в принципе имеют большую массу на единицу объёма. Например, атом брома и метильная группа имеют практически одинаковый ван-дер-ваальсовский радиус, но атомная масса брома в 5 раз выше. Также плотности всех бромалканов и иодалканов выше плотности воды (1,46 г/мл при 25 °С у бромэтана и 1,936 г/мл у иодэтана). Хлоралканы легче воды (0,891 г/мл у 1-хлорпропана), но ди- и полихлоралканы уже тяжелее воды (1,48 г/мл у хлороформа, 2,89 г/мл у бромоформа, 4,00 у иодоформа)[6].
Получение
Общими методами получения галогеналканов являются реакции галогенирования и гидрогалогенирования, но конкретные способы получения зависят от природы галогена[7].
Получение фторалканов
В промышленности монофторалканы и дифторалканы синтезируют двумя способами. Первый из них заключается в присоединении фтороводорода к алкенам или алкинам. Второй основан на замещении хлора или брома на фтор под действием фтороводорода или фторидов металлов[8].
- [math]\displaystyle{ \mathsf{CH_2\!\!=\!\!CH_2 + HF \rightarrow CH_3CH_2F} }[/math]
- [math]\displaystyle{ \mathsf{RCl + KF \rightarrow RF + KCl} }[/math]
Разработаны также подходы к синтезу моногидроперфторалканов CnHF2n+1. Их получают присоединением HF к перфторалкенам или декарбоксилированием перфторкарбоксилатов в присутствии доноров протонов[8].
Перфторалканы получают фторированием алканов под действием фторида кобальта(III) или фторида серебра(II), а также электрохимическими методами[8].
- [math]\displaystyle{ \mathsf{R_3CH + 2CoF_3 \rightarrow R_3CF + HF + 2 CoF_2} }[/math]
- [math]\displaystyle{ \mathsf{2CoF_2 + F_2 \rightarrow 2 CoF_3} }[/math]
Получение хлоралканов
Хлорметан синтезируют в промышленности как хлорированием метана, так и замещением OH-группы в метаноле под действием хлороводорода. Второй из этих методов набирает всё большую популярность, поскольку он, в отличие от первого, не создаёт в процессе производства побочный хлороводород, который необходимо утилизировать, а расходует его. Комбинация обоих методов позволяет производить хлорметан без особо больших выбросов хлороводорода[9]. Дихлорметан и трихлорметан также получают реакцией хлорирования метана[10]. Для получения тетрахлорметана также используют хлорирование метана, но некоторые заводы основаны на хлоририровании сероуглерода[11].
- [math]\displaystyle{ \mathsf{CH_4 + Cl_2 \xrightarrow[]{hv} CH_3Cl + HCl} }[/math]
- [math]\displaystyle{ \mathsf{CH_3OH + HCl \xrightarrow[]{Al_2O_3} CH_3Cl + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{CS_2 + 2Cl_2 \rightarrow CCl_4 + 2S} }[/math]
Этилхлорид получают хлорированием этана, а более замещенные хлорэтаны — присоединением HCl или Cl2 к этилену или винилхлориду[12]. 2-Хлорпропан образуется при присоединении HCl к пропену[13]. Бутилхлорид и трет-бутилхлорид получают из соответствующих спиртов: бутанола-1 и трет-бутилового спирта под действием HCl[13].
Также в промышленности производят хлорированные парафины, которые представляют собой смеси, полученные воздействием газообразного хлора на смеси алканов с цепью разной длины (C10-C13, C14-C17, C18-C20, C20-C28)[14].
Получение бромалканов
Бромалканы в промышленности получают, в основном, реакциями присоединения и замещения. Бром быстро и количественно присоединяется по двойным углерод-углеродным связям, образуя дибромиды. Монобромиды получают присоединением к алкенам бромоводорода. Если алкен несимметричный, то региоселективность такого присоединения зависит от условий реакции: в условиях ионного механизма оно отвечает правилу Марковникова. Если реакцию проводить в радикальных условиях, её региоселективность противоположна (образуется менее замещённый бромид)[15].
- [math]\displaystyle{ \mathsf{RCH\!\!=\!\!CH_2 + HBr \xrightarrow[]{FeBr_3} RCHBrCH_3} }[/math]
- [math]\displaystyle{ \mathsf{RCH\!\!=\!\!CH_2 + HBr \xrightarrow[]{O_2} RCH_2CH_2Br} }[/math]
Реакции замещения заключаются в замещении некоторого атома в органическом соединении на бром. В случае алканов реакцию проводят с использованием молекулярного брома при термическом, фотохимическом или ином инициировании. Такое замещение оказывается полезным только в том случае, если замещение происходит не случайным образом в нескольких положениях, а преимущественно в одном — там, где атом водорода отрывается наиболее легко[15].
- [math]\displaystyle{ \mathsf{R_3CH + Br_2 \xrightarrow[]{t, hv} R_3CBr + HBr} }[/math]
Также в промышленности применяются другие реакции замещения на бром:
- замещение гидроксильной группы под действием HBr, PBr3 или P/Br2;
- замещение хлора;
- замещение карбоксильной группы при обработке солей карбоновых кислот бромом или бромидом натрия в присутствии оксона[15].
Иногда токсичный молекулярный бром можно заменить другими бромирующими агентами: N-бромсукцинимидом, 1,3-дибром-5,5-диметилгидантоином, трибромизоциануровой кислотой, а также кристаллическими трибромидами аммония, сульфония и фосфония[15].
Получение иодалканов
Иодалканы получают, обрабатывая спирты смесью иода и красного фосфора. Так, например, получают иодметан и иодэтан. Также применяют реакции присоединения иода или галогенидов иода к алкенам, замещения хлора или брома под действием иодидов щелочных металлов и реакцию спиртов с трифенилфосфитом и иодметаном[16].
Химические свойства
Реакции нуклеофильного замещения
Галогеналканы вступают в реакции с разнообразными нуклеофилами. В этих процессах нуклеофил присоединяется к атому углерода, связанному с галогеном, а атом галогена выступает как уходящая группа. Суммарно происходит замещение атома галогена нуклеофилом.
- [math]\displaystyle{ \mathsf{Nu^- + R\!\!-\!\!X \rightarrow R\!\!-\!\!Nu + X^-} }[/math]
Благодаря разнообразию нуклеофилов галогеналканы можно превратить в органические соединения самых различных классов: спирты, амины, простые и сложные эфиры, нитрилы, другие галогеналканы и т. д.[17].
- [math]\displaystyle{ \mathsf{RCH_2X + NaOH \rightarrow RCH_2OH + NaX} }[/math]
- [math]\displaystyle{ \mathsf{RCH_2X + NH_3 \rightarrow RCH_2NH_3^+X^- \rightarrow RCH_2NH_2} }[/math]
- [math]\displaystyle{ \mathsf{RCH_2X + RONa \rightarrow RCH_2OR + NaX} }[/math]
- [math]\displaystyle{ \mathsf{RCH_2X + RCOONa \rightarrow RCH_2OCOR + NaX} }[/math]
- [math]\displaystyle{ \mathsf{RCH_2X + NaCN \rightarrow RCH_2CN + NaX} }[/math]
- [math]\displaystyle{ \mathsf{RCH_2X + NaI \rightarrow RCH_2I + NaX} }[/math]
Все эти реакции протекают преимущественно по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2. Оба приводят к одному и тому же продукту с точки зрения структуры, но имеют некоторые кинетические и стереохимические отличия[17].
Механизм SN1 характерен для третичных галогенидов и других галогенидов, которые при отщеплении галогенид-иона дают устойчивые карбокатионы (например, аллилгалогенидов и бензилгалогенидов). Вторичные галогениды вступают в эту реакцию медленнее, а первичные — совсем медленно. Согласно механизму SN1, реакция нуклеофильного замещения протекает в две стадии: сначала происходит гетеролитический разрыв связи С-Х, а затем образовавшийся карбокатион реагирует с нуклеофилом. Реакция имеет первый порядок по субстрату; её скорость не зависит от концентрации нуклеофила. Если в исходном галогениде атом галогена был связан с хиральным атомом углерода, то в ходе реакции хиральность утрачивается и образуется рацемический продукт[17].

Механизм SN2 характерен для первичных галогенидов и чуть менее для вторичных галогенидов, поскольку его реализации мешают стерические препятствия, возникающие в сильно замещённых галогенидах. Согласно механизму SN2, реакция нуклеофильного замещения протекает в одну стадию: нуклеофил образует связь с атомом углерода при одновременном разрыве связи с уходящей группой. Реакция имеет первый порядок по субстрату и первый порядок по нуклеофилу. Если в исходном галогениде атом галогена был связан с хиральным атомом углерода, то в ходе реакции происходит обращение конфигурации: [17].

Реализация конкретного механизма зависит от типа галогенида (стерических препятствий, стабилизации карбокатиона), нуклеофильности реагента, характера растворителя (его ионизирующей и сольватационной способности), природы уходящей группы[17].
Реакции отщепления
Под действием оснований, в том числе щелочей, происходит отщепление галогеноводородов HX от галогеналканов и образуются алкены. Такие реакции также называют β-элиминированием (по месту отщепления атома водорода) и классифицируют по механизмам E1 (мономолекулярный) и E2 (бимолекулярный)[18].
В бимолекулярном механизме E2 происходит синхронное отщепление протона основанием, образование двойной С=С-связи и отщепление уходящей группы. В механизме E1 (также E1cB) стадия отщепления протона выделяется в отдельную стадию и является скоростьлимитирующей[18].
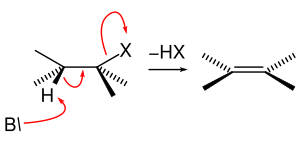

Если при отщеплении галогеноводорода может получиться два изомерных алкена, их соотношение регулируется правилом Зайцева. Основания, которые применяются при проведении реакций отщепления, являются также нуклеофилами, поэтому с реакциями отщепления конкурируют реакции нуклеофильного замещения[18].
Тригалогенметаны вступают в реакции α-элиминирования, когда протон и галогенид-ион отщепляются у одного и того же атома углерода. При этом происходит образование карбенов[18].
- [math]\displaystyle{ \mathsf{CHCl_3 + NaOH \rightarrow CCl_2 + NaCl + H_2O} }[/math]
Известно также отщепление молекул галогена от дигалогенидов. Под действием цинка в спиртовой среде 1,2-дигалогениды превращаются в алкены. Если атомы галогена расположены в более удалённых положениях эта реакция приводит к образованию циклоалканов[7].
Получение металлоорганических соединений
Галогеналканы реагируют с активными металлами, образуя металлоорганические соединения либо продукты их дальнейшего превращения. При реакции с натрием происходит образование натрийорганического соединения, которое реагирует со второй молекулой галогеналкана, давая алкан с удвоенным числом атомов углерода. Данное превращение известно как реакция Вюрца[19].

В среде диэтилового эфира или ТГФ галогеналканы вступают в реакцию с металлическим магнием, образуя реактивы Гриньяра RMgX. Эти реагенты широко используются в органическом синтезе в качестве нуклеофильных реагентов[19]. Аналогичным способом, по реакции с литием, получают литийорганические реагенты[7].

Реакция Фриделя — Крафтса
Галогеналканы применяют для алкилирования по Фриделю — Крафтсу. При этом галогеналканы реагируют с ароматическими соединениями в присутствии кислот Льюиса[7].

Применение
Применение фторалканов
Фторалканы представляют интерес как более безопасный класс фреонов по сравнению с хлорсодержащими фреонами. Последние выходят из употребления в связи с запретами в законодательстве различных стран. Фторалканы не оказывают вредного воздействия на озоновый слой и оказывают низкий вклад в парниковый эффект. Перфторалканы (например, перфтордекалин) применяются в производстве кровезаменителей[20].
Применение хлоралканов
Большую долю рынка хлорметанов занимает четырёххлористый углерод, основное использование которого заключается в дальнейшем производстве фреонов трихлорфторметана (R-11) и дифтордихлорметана (R-12). С 1976 года, когда появилась теория разрушения озонового слоя, производство четырёххлористого углерода снижается. Также его применяют как дезинфицирующее средство и фунгицид для зерновых[21].
Хлорметан и дихлорметан занимают по 25 % рынка хлорметанов. Хлорметан расходуется преимущественно на производство силиконов (60-80 % от рынка). Его использование в производстве топливной присадки тетраметилсвинца постепенно сокращается. Дихлорметан используют преимущественно в качестве моющего средства и растворителя для краски (40-45 %), для создания давления в аэрозолях (20-25 %), а также в качестве экстрагирующего растворителя[21].
Трихлорметан среди хлорметанов занимает наименьшую долю рынка (16 %). В основном он используется для производства дифторхлорметана (R-22) (90 % от производимого количества). Также он находит применение как экстрагирующий растворитель. Из-за токсикологических свойств его практически не применяют в качестве ингаляционного анестетика[21].
Хлорэтан находит широкое применение в производстве тетраэтилсвинца. По состоянию на 2006 год, 80-90 % хлорэтана в США и около 60 % в Европе приходилось на эту отрасль. Поскольку потребность в этой присадке резко уменьшается, сокращается также и производство хлорэтана. В сравнительно небольшом количестве хлорэтан используется для получения этилцеллюлозы и для реакций алкилирования[22].
1,1-Дихлорэтан используется главным образом как сырьё для производства 1,1,1-трихлорэтана[23]. 1,2-Дихлорэтан в основном используется (по данным 1981 года) для получения винилхлорида (около 85 % от общего количества). Около 10 % 1,2-дихлорэтана расходуют на производства других хлорсодержащих растворителей. Остальная часть находит применение в производстве этилендиаминов[24].
1,1,1-Трихлорэтан используют как промышленный растворитель, а также в текстильной промышленности и химчистка[25]. Более токсичный 1,1,2-трихлорэтан нельзя использовать как растворитель, поэтому он используется как промежуточное соединение в производстве 1,1,1-трихлорэтана и 1,1-дихлорэтилена[26].
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 Favre H. A., Powell W. H. Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013. — The Royal Society of Chemistry, 2014. — P. 656–661. — doi:10.1039/9781849733069-FP001.
- ↑ Перейти обратно: 2,0 2,1 2,2 2,3 2,4 Химическая энциклопедия, 1988, с. 485.
- ↑ Перейти обратно: 3,0 3,1 Brown, 2012, p. 298–299.
- ↑ Brown, 2012, p. 301.
- ↑ Brown, 2012, p. 299–300.
- ↑ Brown, 2012, p. 300–301.
- ↑ Перейти обратно: 7,0 7,1 7,2 7,3 Химическая энциклопедия, 1988, с. 486.
- ↑ Перейти обратно: 8,0 8,1 8,2 Siegemund et al., 2016, p. 7–8.
- ↑ Rossberg et al., 2006, p. 12.
- ↑ Rossberg et al., 2006, p. 14.
- ↑ Rossberg et al., 2006, p. 18.
- ↑ Rossberg et al., 2006, p. 30–50.
- ↑ Перейти обратно: 13,0 13,1 Rossberg et al., 2006, p. 83.
- ↑ Strack et al., 2011, p. 523–524.
- ↑ Перейти обратно: 15,0 15,1 15,2 15,3 Yoffe et al., 2013, p. 6–8.
- ↑ Lyday and Kaiho, 2015, p. 10.
- ↑ Перейти обратно: 17,0 17,1 17,2 17,3 17,4 Нейланд, 1990, с. 229–233.
- ↑ Перейти обратно: 18,0 18,1 18,2 18,3 Нейланд, 1990, с. 233–234.
- ↑ Перейти обратно: 19,0 19,1 Нейланд, 1990, с. 229.
- ↑ Siegemund et al., 2016, p. 10.
- ↑ Перейти обратно: 21,0 21,1 21,2 Rossberg et al., 2006, p. 25–26.
- ↑ Rossberg et al., 2006, p. 32.
- ↑ Rossberg et al., 2006, p. 34.
- ↑ Rossberg et al., 2006, p. 42.
- ↑ Rossberg et al., 2006, p. 46.
- ↑ Rossberg et al., 2006, p. 49.
Литература
- Трегер Ю. А. Галогензамещенные углеводородов // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 485–487. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- Нейланд О. Я. Органическая химия. — М. : Высшая школа, 1990. — С. 218–236. — ISBN 5-06-001471-1.
- Brown W. H., Foote C. S., Iverson B. L., Anslyn E. V. Organic Chemistry. — 6th ed. — Brooks/Cole, 2012. — P. 296–389. — ISBN 978-0-8400-5498-2.
Ullmann’s Encyclopedia of Industrial Chemistry
- Siegemund G., Schwertfeger W., Feiring A., Smart B., Behr F., Vogel H., McKusick B., Kirsch P. Fluorine Compounds, Organic (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2016. — doi:10.1002/14356007.a11_349.pub2.
- Rossberg M., Lendle W., Pfleiderer G., Tögel A., Dreher E.-L., Langer E., Rassaerts H., Kleinschmidt P., Strack H., Cook R., Beck U., Lipper K.-A., Torkelson T. R., Löser E., Beutel K. K., Mann T. Chlorinated Hydrocarbons (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2006. — doi:10.1002/14356007.a06_233.pub2.
- Strack H., Cook R., Mann T. Chlorinated Paraffins (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2011. — doi:10.1002/14356007.o06_o02.
- Yoffe D., Frim R., Ukeles S. D., Dagani M. J., Barda H. J., Benya T. J., Sanders D. C. Bromine Compounds (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi:10.1002/14356007.a04_405.pub2.
- Lyday P. A., Kaiho T. Iodine and Iodine Compounds (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2015. — doi:10.1002/14356007.a14_381.pub2.
Ссылки
- Номенклатура галогенопроизводных по ИЮПАК Архивная копия от 18 октября 2016 на Wayback Machine (рус.)