Бромэтан
| Бромистый этил | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Бромэтан |
| Традиционные названия | Этил бромистый, бромэтил, этилбромид |
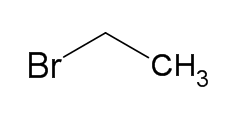
| Рац. формула | СH3СH2Br |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 108,97 г/моль |
| Плотность | 1,43; 1,50138 (0 °C), 1,4555 (20 °C)[1] |
| Термические свойства | |
| Температура | |
| • плавления | -119, 125,5 °C |
| • кипения | 38,0, 38,4 °C |
| • вспышки | -25 °C °C |
| Критическая точка | |
| • давление | 6,23 МПа[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,08 (0 °C), 0,96 (17 °C) |
| Оптические свойства | |
| Показатель преломления | 1,42386[2] |
| Классификация | |
| Рег. номер CAS | 74-96-4 |
| Безопасность | |
| ЛД50 | ЛК50: 36 мг/м3 (белые мыши, 2 ч) , 53 мг/м3 (белые крысы, 4 ч) |
| Токсичность | высокотоксичен, обладает наркотическим действием |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бромэтан (бромистый этил, этилбромид) C2H5Br — прозрачная бесцветная или слегка желтоватая токсичная жидкость с запахом хлороформа.
Получение
При промышленном производстве бромистый этил получают из этилена:
- [math]\displaystyle{ \mathsf{ CH_2{{=}}CH_2 + HBr \ \xrightarrow{\ \ \ }\ CH_3{{-}}CH_2{{-}}Br }. }[/math]
В лабораторных условиях бромэтил получают действием бромоводорода на этанол. Чаще всего бромоводород получают in situ из бромида калия и серной кислоты[3]:
- [math]\displaystyle{ \mathsf{ KBr + H_2SO_4 \ \xrightarrow{}\ HBr + KHSO_4}, }[/math]
- [math]\displaystyle{ \mathsf{ CH_3CH_2{{-}}OH + HBr \ \xrightarrow{H_2SO_4}\ CH_3CH_2{{-}}Br + H_2O}. }[/math]
Другие лабораторные способы:
- [math]\displaystyle{ \mathsf{ CH_3CH_2{{-}}OH + PBr_3 \ \xrightarrow{\ \ \ }\ CH_3CH_2{{-}}Br + P(OH)_3}, }[/math]
- [math]\displaystyle{ \mathsf{ CH_3CH_2{{-}}OH + PBr_5 \ \xrightarrow{\ \ \ }\ CH_3CH_2{{-}}Br + PO(OH)_3 + HBr}. }[/math]
Способы получения, редко используемые на практике:
- [math]\displaystyle{ \mathsf{ CH_3{{-}}CH_3 + Br_2 \ \xrightarrow{h\nu}\ CH_3CH_2{{-}}Br + HBr}, }[/math]
- [math]\displaystyle{ \mathsf{ CH_3CH_2{{-}}COOAg + Br_2 \ \xrightarrow{\ \ \ }\ CH_3CH_2{{-}}Br + CO_2 + AgBr}. }[/math]
Физические свойства
Бромэтил — прозрачная бесцветная или слегка желтоватая жидкость с запахом хлороформа. Под действием света и воздуха (кислорода) легко разлагается, поэтому его следует хранить в герметически закупоренных темных склянках.
Химические свойства
В воде, как и многие галогенопроизводные, медленно гидролизуется:
- [math]\displaystyle{ \mathsf{ CH_3CH_2Br + H_2O \rightleftharpoons\ CH_3CH_2{{-}}OH + HBr}. }[/math]
Со щелочами взаимодействие идёт быстрее и двумя путями:
- [math]\displaystyle{ \mathsf{ CH_3CH_2Br + NaOH \ \xrightarrow{\ H_2O \ \ }\ CH_3CH_2{{-}}OH + NaBr}, }[/math]
- [math]\displaystyle{ \mathsf{ CH_3CH_2Br + NaOH \ \xrightarrow{\ alcohol\ \ }\ CH_2{{=}}CH_2 + NaBr + H_2O}. }[/math]
Применение
Применяется в медицинской промышленности, в производстве этиловой жидкости, как химсырье органического синтеза, а также в качестве рабочего вещества или компонента в автоматических системах пожаротушения, наркотик с узким терапевтическим диапазоном, вызывает повреждение миокарда.
Токсичность
Бромэтан в больших количествах токсичен. При остром отравлении наблюдаются наркотическое состояние, тахикардия, цианоз, коллапс. ЛК50: 36 мг/л (белые мыши, экспозиция 2 ч.), 53 мг/л (белые крысы, экспозиция 4 ч.)[4].
Литература
- Кремлёв А. М., Менделеев Д. И.,. Этил бромистый // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. В 2-х томах. — 2-е изд., пер. — М.: «Химия», 1974. — Т. 1. — 624 с.
Примечания
- ↑ Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ Перейти обратно: 2,0 2,1 Бромистый этил. Архивная копия от 25 марта 2013 на Wayback Machine
- ↑ Лабораторные работы по органической химии. Под ред. О. Ф. Гинзбурга. М.: Высш. шк., 1970.
- ↑ Токсичность бромэтила Архивная копия от 25 марта 2013 на Wayback Machine