Реакции электрофильного присоединения
Реакции электрофильного присоединения (англ. addition electrophilic reaction) — реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся карбкатион подвергается нуклеофильной атаке.
В органической химии чаще всего атакующей электрофильной частицей является протон H+.
Несмотря на общность механизма различают реакции присоединения по связи углерод—углерод и углерод—гетероатом.
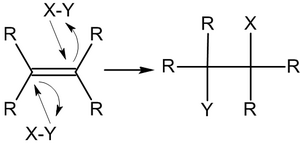
Общий вид реакций присоединения по двойной связи углерод-углерод:
[math]\displaystyle{ \mathsf{-\stackrel{|}{C}\!\!=\!\!\stackrel{|}{C}\!\!-+\ X^+}\rightarrow\mathsf{-\stackrel{|\ }{C^+}\!\!-\!\!\stackrel{|\ }{CX}\!-} }[/math]
[math]\displaystyle{ \mathsf{-\stackrel{|\ }{C^+}\!\!-\!\!\stackrel{|\ }{CX}\!-\!+\ Y^-}\rightarrow\mathsf{-\stackrel{|\ }{CY}\!\!-\!\!\stackrel{|\ }{CX}\!-} }[/math]
Реакции электрофильного присоединения распространены среди алкенов и алкинов и широко используются в промышленном химическом производстве и лабораторных синтезах.
Реакции электрофильного присоединения по связи углерод-углерод
Механизм реакций электрофильного присоединения по связи углерод-углерод
Электрофильное присоединение по кратной связи обычно двухстадийный процесс AdE2 — реакция бимолекулярного электрофильного присоединения (англ. addition electrophilic bimolecular). На первом этапе происходит атака электрофила и образование π-комплекса, который затем расщепляется, а далее образовавшийся карбкатион подвергается нуклеофильной атаке[1]:
Обычно скорость лимитирующей является первая стадия реакции, хотя встречаются редкие исключения[2].
Аналогично происходит присоединение к алкинам:
Реже встречается механизм AdE3 — реакция тримолекулярного электрофильного присоединения с одновременной атакой трех частиц[2]:
Реакции электрофильного присоединения более характерны для непредельных соединений, чем нуклеофильного, что объясняется пространственной доступностью π-электронов двойной связи электронодефицитных атакующих частиц X+[1].
Как и в реакциях ароматического электрофильного замещения, электронодонорные заместители повышают реакционную способность субстрата, а электроноакцепторные её снижают[2].
Присоединение галогенов
Присоединение галогенов по механизму AdE2 является едва ли не самой распространенной реакцией подобного рода. На первом этапе образуется π-комплекс, который в дальнейшем преобразуется в σ-комплекс и далее в дигалогенпроизводное[3]:
Присоединение брома — анти-присоединение, то есть присоединение с противоположной стороны, относительно плоскости молекулы алкена[3]. Это весьма наглядно представляется с помощью формул Ньюмена.
Подтверждение данного механизма обнаруживается при исследовании бромирования малеиновой и фумаровой кислот.
В первом случае образуется смесь энантиомеров, во втором — только один продукт:
Кинетика реакции бромирования обычно довольно сложна[3]:
| Скорость реакции = k1*[RRC=CRR]*[Br2]+k2*[RRC=CRR]*[Br2]²+k3*[RRC=CRR]*[Br2]*[Br-] |
Хлорирование чаще дает более простую зависимость [4]:
| Скорость реакции = k1*[RRC=CRR]*[Cl2] |
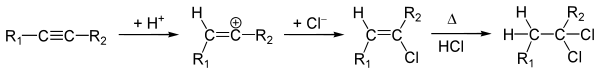
Присоединение галогеноводородов
В отсутствии свободных радикалов* присоединение галогеноводородов подчиняется правилу Марковникова:
* Возможность проведения присоединения по свободнорадикальному механизму реализуется только для HBr и в редких случаях для HCl[2]
Стереохимически присоединение галогеноводородов к алкенам, обычно — анти-присоединение[4]. К син-присоединению склонны стирол, инден, аценафтилен и их производные[3].
Алкины способны присоединить две молекулы галогеноводорода:
Другие типичные реакции электрофильного присоединения
1. Гидратация.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\! CH_2+H_2O}\rightarrow\mathsf{R\!\!-\!\!CH(OH)\!\!-\!\!CH_3} }[/math]
2. Присоединение спирта с образованием простого эфира.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!OH}\rightarrow\mathsf{R\!\!-CH(OR')\!\!-CH_3} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'\!\!-\!\!OH}\rightarrow\mathsf{R\!\!-C(OR')\!\!=CH_2} }[/math]
3. Присоединение хлорноватистой кислоты с образованием хлоргидринов.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+Cl_2+ H_2O}\rightarrow\mathsf{R\!\!-\!\!CH(OH)\!\!-\!\!CH_2Cl +HCl} }[/math]
4. Присоединение хлорангидридов и/или карбоновых кислот.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!COCl}\rightarrow\mathsf{R\!\!-\!\!CHCl\!\!-\!\! CH_2COR'} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'\!\!-\!\!COOH}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2OCOR'} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'\!\!-\!\!COOH}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CHOCOR'} }[/math]
5. Присоединение аммиака и/или аминов.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+NH_3}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2NH_2} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+R'NH_2}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2NHR'} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+R'NH_2}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CH\!\!-\!\!NHR'}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\!CH\!\!=\!\!NR'} }[/math]
6. Карбонилирование.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CH\!\!=\!\!CH_2+CO+HY}\rightarrow\mathsf{R\!\!-\!\!CH_2\!\!-\!\! CH_2COY} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!C\!\!\equiv\!\!CH+CO+HY}\rightarrow\mathsf{R\!\!-\!\!CH\!\!=\!\! CHCOY} }[/math]
[math]\displaystyle{ \mathsf{HY: H_2O, ROH, RCOOH, NH_3, RNH_2, HCN} }[/math].
Реакции электрофильного присоединения по связи углерод-гетероатом
Механизм реакций электрофильного присоединения по связи углерод-гетероатом
Электрофильное присоединение по кратной связи углерод-гетероатом имеет механизм AdE3:
Иногда продукты присоединения вступают в реакцию отщепления, тем самым совокупно давая реакцию замещения:
Связи углерод-гетероатом очень полярны, при этом на углероде формируется положительный заряд, а на гетероатоме — отрицательный. Соответственно, первоначальная атака может идти как по атому углерода (электрофильная атака), так и по гетероатому (нуклеофильная атака). В подавляющем большинстве случаев реакции присоединения по кратной связи углерод-гетероатом носят нуклеофильный характер[2].
Типичные реакции электрофильного присоединения по связи C=O
1. Присоединение нитрилов к альдегидам.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CHO+2R'CN}\rightarrow\mathsf{R\!\!-\!\!CH(NHCOR')_2} }[/math]
2. Реакция Принса.
Типичные реакции электрофильного присоединения по связи C=N и С≡N
1. Реакция Риттера.
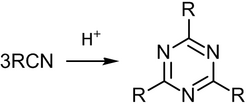
2. Тримеризация нитрилов.
3. Гидролиз нитрилов и изонитрилов.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CN+H_2O}\rightarrow\mathsf{R\!\!-\!\!CO\!\!-\!\!NH_2} }[/math]
[math]\displaystyle{ \mathsf{R\!\!-\!\!NC+H_2O}\rightarrow\mathsf{R\!\!-\!\!NH\!\!-\!\!CHO} }[/math]
4. Алкоголиз нитрилов.
[math]\displaystyle{ \mathsf{R\!\!-\!\!CN+R'OH+H_2O+H^+}\rightarrow\mathsf{R\!\!-\!\!CO\!\!-\!\!OR'+NH_4^+} }[/math]
Примечания
- ↑ Перейти обратно: 1,0 1,1 Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- ↑ Перейти обратно: 2,0 2,1 2,2 2,3 2,4 Mарч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑ Перейти обратно: 3,0 3,1 3,2 3,3 Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ Перейти обратно: 4,0 4,1 Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.