Кетоны
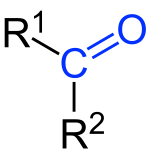
Кето́ны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1-CO-R2.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Этимология
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853)[1].
Номенклатура
Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоначального углеводорода.[2] Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон.[3]
Другие номенклатуры
Тривиальная номенклатура. Для простейших кетонов используются их тривиальные названия, например, ацетон (для пропанона) и бензофенон (для дифенилкетона).
Радикало-функциональная номенклатура. Допускается название кетонов по радикально-функциональной номенклатуре, при этом название составляется из радикалов при кетогруппе (в алфавитном порядке) и названия класса соединений (функции) -кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
История открытия кетонов
Ацетон был открыт Робертом Бойлем в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
- [math]\displaystyle{ \mathsf{ Ca(CH_3COO)_2 \xrightarrow t {} (CH_3)_2CO + CaCO_3} }[/math]
Похожая реакция была описана Андреасом Либавием — ацетон образовывался при нагревании свинцового сахара (ацетата свинца(II)). Установить состав этого вещества удалось только в 1852 году Александру Уильяму Уильямсону[4].
Физические свойства
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых соотношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой (например, ацетон кипит при 56,1 °C, а пропанол-2 — при 82,4 °C).
Методы синтеза
- Ароматические кетоны могут быть получены по реакции Фриделя-Крафтса.
- Гидролизом кетиминов.
- Из третичных пероксоэфиров перегруппировкой Криге.
- Кислотным гидролизом виц-диолов.
- Окислением вторичных спиртов.[5]
- Окисление с помощью ДМСО.
- Циклокетоны можно получить циклизацией Ружички.
- Гидратация гомологов ацетилена (реакция Кучерова).
- Кетоны с хорошими выходами получаются при взаимодействии хлорангидридов кислот с диалкилкупратами лития и алкилкадмиевыми соединениями:
- [math]\displaystyle{ \mathsf{R_2CuLi + R'COCl \rightarrow RC(O)R' + LiCl+ CuR} }[/math]
- [math]\displaystyle{ \mathsf{2RCOCl + Cd(C_2H_5)_2 \rightarrow 2RC(O)C_2H_5 + CdCl_2} }[/math]
Химические свойства
Кето-енольная таутомерия

Кетоны, которые имеют по крайней мере один альфа-водородный атом, подвергаются кето-енольной таутомеризации. Таутомеризация катализируется как кислотами, так и основаниями. Как правило, кето-форма является более стабильной, чем енольная. Это равновесие позволяет получать кетоны путём гидратации алкинов. Относительная стабилизация енольной формы сопряжением является причиной довольно сильной кислотности кетонов (pKa ≈ 20) в сравнении с алканами (pKa ≈ 50).
Гидрирование
Присоединение водорода к кетонам происходит в присутствии катализаторов гидрирования (Ni, Co, Cu, Pt, Pd и др.). В последнее время в качестве гидрирующего агента часто используют алюмогидрид лития. При этом кетоны превращаются во вторичные спирты:
- [math]\displaystyle{ \mathsf{R_2CO + 2H \rightarrow R_2CH(OH)} }[/math]
При восстановлении кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамы магния) образуются также гликоли (пинаконы):
- [math]\displaystyle{ \mathsf{2R_2CO + 2H \rightarrow R_2C(OH){-}CR_2(OH)} }[/math]
Реакции нуклеофильного присоединения
- Реакции с алкилмагнийгалогенидами приводит к вторичным спиртам.
- Реакция с синильной кислотой приводит к α-оксинитрилам, омылением которых получают α-гидроксикислоты:
- [math]\displaystyle{ \mathsf{(CH_3)_2CO + HCN \rightarrow (CH_3)_2C(OH)CN} }[/math]
- [math]\displaystyle{ \mathsf{(CH_3)_2C(OH)CN + 2H_2O \rightarrow (CH_3)_2C(OH)COOH + NH_3} }[/math]
- С аммиаком реагируют очень медленно:
- [math]\displaystyle{ \mathsf{(CH_3)_2CO \xrightarrow[OH-]{} (CH_3)_2C{=}CH{-}C(O){-}CH_3 \xrightarrow[+NH_3]{} (CH_3)_2C(NH_2)CH_2{-}C(O){-}CH_3} }[/math]
- Присоединение гидросульфита натрия даёт гидросульфитные (бисульфитные) производные (в реакцию в жирном ряду вступают лишь метилкетоны):
- [math]\displaystyle{ \mathsf{RC(O)CH_3+ HSO_3Na \rightarrow R{-}C(OH)(SO_3Na){-}CH_3} }[/math]
При нагревании с раствором соды или минеральной кислотой гидросульфитные производные разлагаются с выделением свободного кетона:
- [math]\displaystyle{ \mathsf{2R{-}C(OH)(SO_3Na){-}CH_3 + Na_2CO_3 \rightarrow 2RC(O)CH_3 + 2Na_2SO_3 + CO_2 + H_2O } }[/math]
- С гидроксиламином кетоны образуют кетоксимы, выделяя воду:
- [math]\displaystyle{ \mathsf{(CH_3)_2CO + NH_2OH \rightarrow H_2O + (CH_3)_2C{=}N{-}OH} }[/math]
- С гидразином в зависимости от условий образуются гидразоны (соотношение гидразина к кетону 1:1) или азины (1:2):
- [math]\displaystyle{ \mathsf{(CH_3)_2CO + N_2H_4 \rightarrow (CH_3)_2C{=}N{-}NH_2 + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{2(CH_3)_2CO + N_2H_4 \rightarrow (CH_3)_2-C{=}N{-}N{=}C-(CH_3)_2 + 2H_2O} }[/math]
Как и в случае альдегидов, при нагревании с твёрдым KOH гидразоны кетонов выделяют азот и дают предельные углеводороды (реакция Кижнера)
- Ацетали кетонов получаются сложнее, чем ацетали альдегидов, — действием на кетоны эфиров ортомуравьиной HC(OC2H5)3 или ортокремниевой кислоты.
Реакции конденсации
В жёстких условиях (в присутствии щелочей) кетоны подвергаются альдольной конденсации. При этом образуются β-кетоспирты, легко теряющие молекулу воды.
В ещё более жестких условиях, например при нагревании с концентрированной серной кислотой, кетоны подвергаются межмолекулярной дегидратации с образованием непредельных кетонов:
- [math]\displaystyle{ \mathsf{2(CH_3)_2CO \rightarrow H_2O + (CH_3)_2C{=}CH{-}C(O){-}CH_3 } }[/math]
Окись мезитила может реагировать с новой молекулой ацетона с образованием форона:
- [math]\displaystyle{ \mathsf{(CH_3)_2C{=}CH{-}C(O){-}CH_3 + (CH_3)_2CO \rightarrow (CH_3)_2C{=}CH{-}C(O){-}CH{=}C(CH_3)_2 } }[/math]
К отдельному типу реакций можно отнести восстановление кетонов — реакция Лейкарта — Валлаха.
Важнейшие кетоны
| Название | Формула | Температура плавления | Температура кипения |
|---|---|---|---|
| Ацетон (диметилкетон) |  |
−95 °C | 56,1 °C |
| Метилэтилкетон | CH3CH2-CO-CH3 | −86 °C | 80 °C |
| Диэтилкетон | CH3CH2COCH2CH3 | −40 °C | 102 °C |
| Ацетофенон | 19 °C | 202 °C | |
| Бензофенон | 
|
47.9 °C | 305.4 °C |
| Циклогексанон | −16.4 °C | 155.65 °C | |
| Диацетил | CH3COCOCH3 | −3 °C | 88 °C |
| Ацетилацетон | CH3COCH2COCH3 | −23 °C | 140 °C |
| Парабензохинон | 115 °C | — |
Биохимия
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Кребса.
Наличие в моче и крови человека избыточного количества кетонов говорит о кетозе или кетоацидозе, что может быть связано с особенностями метаболизма углеводов или связанных с ним патологических процессах.
Применение
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон[6].
См. также
Примечания
- ↑ http://www.etymonline.com/index.php?term=ketone Архивная копия от 17 октября 2012 на Wayback Machine Online Etymology Dictionary
- ↑ Правила наименования алифатических кетонов по IUPAC (англ.). Дата обращения: 15 февраля 2022. Архивировано 15 февраля 2022 года.
- ↑ Правила наименования хинонов по IUPAC (англ.). ACD/Labs. Дата обращения: 24 августа 2009. Архивировано 21 августа 2011 года.
- ↑ Аксёнова М., Леенсон И. Химия. Энциклопедия для детей. — Аванта+, 2007. — P. 357—359. — ISBN 978-5-98986-036-4.
- ↑ Получение.. medlec.org. Дата обращения: 20 июля 2016.
- ↑ Hardo Siegel, Manfred Eggersdorfer. "Ketones" (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2005. — doi:10.1002/14356007.a15_077.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
- Химическая Энциклопедия в 5 томах ред. И. Л. Кнунянц 2 том



