Пероксид водорода
| Пероксид водорода | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Пероксид водорода | ||
| Традиционные названия | Перекись водорода | ||
| Хим. формула | H2O2 | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 34,01 г/моль | ||
| Плотность | 1.4 г/см³ | ||
| Кинематическая вязкость |
1,245 см²/с (при 20 °C) |
||
| Термические свойства | |||
| Температура | |||
| • плавления | −0,432 °C | ||
| • кипения | 150,2 °C | ||
| Энтальпия | |||
| • образования | -136.11 кДж/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] | 11.65 | ||
| Растворимость | |||
| • в воде | Неограниченная | ||
| Классификация | |||
| Рег. номер CAS | 7722-84-1 | ||
| SMILES |
|
||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Перокси́д водоро́да (пе́рекись водоро́да, химическая формула — H2O2) — неорганическое химическое соединение водорода и кислорода, являющееся простейшим представителем класса пероксидов.
Физические свойства

Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Водородный показатель — 4.75. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
При стандартных условиях, пероксид водорода — это бесцветная сиропообразная[1] тяжёлая полярная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и диэтиловом эфире.
Также он является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Концентрированные водные растворы пероксида водорода взрывоопасны.
Химические свойства
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. Чистое вещество крайне неустойчиво и разлагается с выделением теплоты, поэтому в высококонцентрированных его растворах и в пергидроле присутствуют стабилизирующие добавки. Однако в разбавленных водных растворах пероксид водорода сравнительно устойчив[1]. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
- [math]\displaystyle{ \mathsf{2H_2O_2 \rightarrow 2H_2O + O_2}. }[/math]
В присутствии катализаторов разложения в среде кислорода может появляться озон:
- [math]\displaystyle{ \mathsf{H_2O_2 + O_2 \rightarrow H_2O + O_3\uparrow}. }[/math]
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
- [math]\displaystyle{ \mathsf{H_2O_2 \rightleftarrows H^++HO_2^-;~~~~~~HO_2^- \rightleftarrows H^++O_2^{2-}}. }[/math]
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
- [math]\displaystyle{ \mathsf{H_2O_2 + 2NaOH \rightarrow Na_2O_2 + 2H_2O}; }[/math]
- [math]\displaystyle{ \mathsf{H_2O_2 + Ba(OH)_2 \rightarrow BaO_2\downarrow + 2H_2O}. }[/math]
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганца при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
- [math]\displaystyle{ \mathsf{H_2O_2 + 2KI + H_2SO_4 \rightarrow I_2 + K_2SO_4 + 2H_2O}. }[/math]
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
- [math]\displaystyle{ \mathsf{O_2^{2-} \rightarrow O_2 + 2e^-}, }[/math]
например:
- [math]\displaystyle{ \mathsf{3H_2O_2 + 2KMnO_4 \rightarrow 2MnO_2 + 2KOH + 3O_2 \uparrow + 2H_2O}. }[/math]
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
- [math]\displaystyle{ \mathsf{5H_2O_2 + 2KMnO_4 + 3H_2SO_4 \rightarrow 5O_2 + 2MnSO_4 + K_2SO_4 + 8H_2O}. }[/math]
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
- [math]\displaystyle{ \mathsf{H_2S_2O_8 + 2H_2O \rightarrow H_2O_2 + 2H_2SO_4}. }[/math]
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[2]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
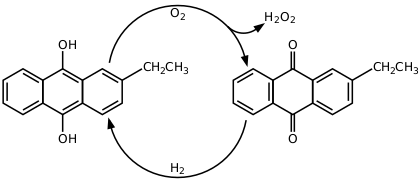
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[3].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта [4]:
- [math]\displaystyle{ \mathsf{(CH_3)_2CHOH + O_2 \rightarrow (CH_3)_2CO + H_2O_2}, }[/math]
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию разбавленной серной кислоты с пероксидом бария:
- [math]\displaystyle{ \mathsf{BaO_2 + H_2SO_4 \rightarrow BaSO_4\downarrow + H_2O_2}. }[/math]
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
При растворении гидроперита в воде образуется пероксид водорода и мочевина.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H[5].
Является одним из промежуточных продуктов сгорания водорода, однако сразу же разлагается на воду и кислород. Но при направлении пламени на лёд можно увидеть следы перекиси водорода[1].
Методы определения концентрации
В разбавленных водных растворах с концентрацией пероксида водорода порядка 10-20 мМ точные значения концентрации могут быть определены спектрофотометрически в ультрафиолетовом диапазоне длин волн. При 240 нм водный раствор пероксида водорода с концентрацией 20 мМ имеет величину поглощения 0.872 при измерении против дистиллированной воды.[6]
Применение

Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[7] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
В медицине и гигиене
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления[8][9]. Обладая хорошими очищающими и определёнными кровоостанавливающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также продлевать время заживления из-за повреждения прилегающих к ране клеток[10]. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи[11].
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
В косметических целях
Пероксид водорода применяется также для обесцвечивания волос[12].
В пищевой промышленности
Растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту
Применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме[13].
Для демонстрации химической реакции
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[14].
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1—6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 2046 дней]. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения
Концентрированные растворы пероксида водорода при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл[15].
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 Общая химия: учебное пособие/Н. Л. Глинка. — Изд. стер. — М.: КНОРУС, 2012. — 752 с. — ISBN 978-5-406-02149-1
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962—6984. — doi:10.1002/anie.200503779. — PMID 17039551.
- ↑ Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society[англ.] : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884—1893. — ISSN 0368-1769. — doi:10.1039/JR9610001884.
- ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Разыграев А.В. Гомоцистеинпероксидазная активность плазмы крови крыс. Стехиометрия и ферментативный характер реакции (рус.) // Биомедицинская химия. — 2013-11-12. — Т. 59, вып. 6. — С. 636–643. — doi:10.18097/pbmc20135906636. Архивировано 11 декабря 2021 года.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds, New York Times (19 июня 2007). Архивировано 10 ноября 2011 года. Дата обращения 13 июля 2011.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don't die easily, CNN (12 июля 2011). Архивировано 10 ноября 2012 года. Дата обращения 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513—519. — doi:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос. Дата обращения: 4 января 2011. Архивировано 9 февраля 2011 года.
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant's Toothpaste (недоступная ссылка). University of Utah Chemistry Demonstrations. University of Utah. Дата обращения: 21 марта 2014. Архивировано 23 декабря 2014 года.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник?]
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.


