Триоксид диводорода
| Триоксид диводорода | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
триоксидан | ||
| Хим. формула | H2O3 | ||
| Рац. формула | HOOOH | ||
| Физические свойства | |||
| Молярная масса | 50,01 г/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] | 9,5 ± 0,5 | ||
| Классификация | |||
| PubChem | 166717 | ||
| SMILES |
|
||
| ChEBI | 46736 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Триоксид диводорода (триоксид водорода, триоксидан) — неорганическое соединение состава H2O3, простейший представитель класса полиоксидов (в т.ч. гидротриоксидов и триоксидов). Может рассматриваться как высший гомолог пероксида водорода H2O2.
Открытие
Впервые о существовании триоксида водорода предположил М. Бертло, который, выступая в 1880 году перед Французской академией наук, заявил об этом веществе как о возможном промежуточном продукте в реакции разложения пероксида водорода. В 1895 году Д. И. Менделеев предложил другой полиоксид — тетраоксид водорода H2O4, в качестве ещё одного промежуточного продукта в этой реакции. Подтверждений этим предположениям в то время приведено не было из-за отсутствия методов, позволивших бы детектировать такие короткоживущие соединения[1].
Косвенное подтверждение существования полиоксидов было получено в результате экспериментов, в которых через водяной пар, пары пероксида водорода либо смесь водорода с кислородом пропускался электрический разряд, а затем следовало резкое охлаждение до −190 °C. После нагревания таких конденсатов до комнатной температуры происходило выделение большого количества кислорода и пероксида водорода, что свидетельствует о наличии в конденсатах соединений с большим содержанием кислорода. Тогда же было снова выдвинуто предположение об образовании триоксида водорода в данных условиях[2].
В 1960—1970-х годах И. И. Некрасовым было проведено изучение полиоксидов методом ИК-спектроскопии. В частности, изучению подверглась реакция между озоном и атомарным водородом при −198 °C, а также диссоциация паров воды и пероксида водорода с последующим замораживанием продуктов. Появившиеся новые полосы в ИК-спектрах были приписаны колебаниям в молекулах HOOOH и HOOOOH, однако убедительной аргументации Некрасов не приводил[2].
В 1963 году Г. Чапский (Czapski) и Б. Бельский (Bielski) обнаружили триоксид водорода в водных растворах, подкисленных хлорной кислотой и облучаемых пучком электронов. Тогда же на основе кинетических данных был установлен максимальный период полуразложения данного соединения в водных растворах, который составил 17 секунд (0,027 М кислота, 0 °C)[2][3].
Методы получения
В 1990-е годы были разработаны методы получения достаточно концентрированных растворов триоксида водорода, что позволило провести его характеризацию физико-химическими методами, а также изучить процессы его разложения и реакционную способность. Эти методы можно разделить на три группы:
- восстановление озона;
- разложение гидротриоксидов ROOOH;
- реакция озона с пероксидом водорода[2].
Восстановление озона
Реакции насыщенных органических соединений с озоном изучались с 1970-х годов. Оказалось, что некоторые из них (изопропиловый спирт, метилизопропиловый эфир, кумол, норкаранол, тетралин, гидразины) реагируют с озоном как восстановители типа AH2, давая в качестве одного из продуктов триоксид водорода HOOOH[2]:
[math]\displaystyle{ \mathsf{AH_2 + O_3} \rightarrow \mathsf{HOOOH + A.} }[/math]
Для данного превращения предлагались различные механизмы. Наиболее вероятной является последовательность стадий, при которой вначале озон отщепляет от органического соединения атом водорода H• (либо — в альтернативном варианте — гидрид-ион H-), а образующаяся радикальная пара (ионная пара) либо превращается в гидротриоксид ROOOH, либо отщепляет атом водорода H• (протон H+) с образованием триоксида водорода. Считается, что в зависимости от природы субстрата, растворителя, температуры и других условий реакции реализуется либо радикальный, либо ионный механизм. В случае реакций изопропилового спирта и гидразобензола (1,2-дифенилгидразина) показан радикальный механизм реакции[4].

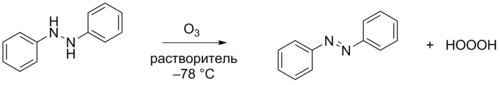
Реакция 1,2-дифенилгидразина с озоном в различных органических растворителях (ацетон-d6, метилацетат, трет-бутилметиловый эфир) при −78 °C даёт триоксид водорода и азоксибензол. Этот метод является основным для приготовления относительно концентрированных растворов триоксида водорода (до 0,1 М) без примесей органических гидротриоксидов ROOOH. Описан метод синтеза чистого продукта путём озонирования гидразобензола, привязанного к нерастворимой полимерной смоле, что позволило отфильтровать в токе аргона образующийся продукт восстановления и получить чистый водный раствор триоксида водорода с примесью лишь пероксида водорода[5][6].
Разложение гидротриоксидов
Триоксид водорода можно получать по реакции разложения гидротриоксидов силанов и германов вида R3XOOOH (X — кремний или германий, R — органический заместитель), сгенерированных путём озонирования соответствующих исходных соединений при температуре от –85 до –10 °C. Обычно реакция разложения гидротриоксидов силанов и германов в органических растворителях даёт триоксид водорода с выходом 40 ± 20 %, а также соответствующие силанолы и германолы, дисилоксаны и дигермоксаны и синглетный кислород. Однако если к растворам гидротриоксидов добавлять воду, то выход существенно увеличивается (80 ± 20 %)[7].
[math]\displaystyle{ \mathsf{R_3SiOOOH + H_2O} \rightarrow \mathsf{HOOOH + R_3SiOH} }[/math]
В 2008 году сообщалось о более эффективном процессе получения триоксида водорода, который заключается в превращении гидротриоксидов под действием каталитических количеств метилтриоксорения(VII) CH3ReO3 при –70 °C. Этот метод позволяет получать чистый триоксид водорода без примесей пероксида водорода и органических гидротриоксидов[8][9].
Реакция пероксида водорода с озоном
Взаимодействие пероксида водорода с озоном изучено давно, а сама смесь используется как сильный окислитель при антибактериальной обработке и очистке почв, грунтовых и сточных вод от различных промышленных загрязнителей (полициклических ароматических углеводородов, бензола, толуола, хлорорганических соединений и др.). Дальнейшее изучение этой реакции показало, что если смешать озон и пероксид водорода в аргоновой матрице, то образуется комплекс, дающий значительные концентрации HOOOH при облучении светом с длиной волны 266 нм. Образование триоксида водорода было подтверждено методом ЯМР-спектроскопии[8][6].
Спектроскопические характеристики
Триоксид водорода был охарактеризован методом ИК-спектроскопии в аргоновой матрице. При этом были обнаружены все 9 фундаментальных колебаний этой молекулы, которые практически совпали с рассчитанными:
- 3529,6 см-1 — симметричное валентное колебание OH;
- 3529,6 см-1 — антисимметричное валентное колебание OH;
- 1359,1 см-1 — антисимметричное деформационное колебание HOO;
- 1347,4 см-1 — симметричное деформационное колебание HOO;
- 821,0 см-1 — симметричное валентное колебание OO;
- 776,3 см-1 — антисимметричное валентное колебание OO;
- 509,1 см-1 — колебание OOO;
- 387,0 см-1 — антисимметричное торсионное колебание;
- 346,4 см-1 — симметричное торсионное колебание[10].
Наиболее важным является колебание при 776 см-1, поскольку в этой области отсутствуют колебания молекул, составляющих атмосферу, а также колебания молекул воды, что делает возможным определение наличия HOOOH в атмосфере и растворах по этой полосе поглощения[11].
В спектрах ЯМР на ядрах 1H триоксид водорода даёт характеристический сигнал при 13,4 ± 0,3 м. д. (калибровка по ТМС). Триоксид дейтерия, полученный путём озонирования дейтерированных органических восстановителей в ацетоне-d6, даёт более широкий сигнал при 13 м. д. в спектрах 2H ЯМР. В спектрах 17O ЯМР соединение даёт два сигнала при 421 и 305 м. д., относящихся к центральному и двум эквивалентным терминальным атомам кислорода соответственно. Если сравнить эти значения с величиной химического сдвига для атомов кислорода в пероксиде водорода (187 м. д.), можно отметить существенное разэкранирование атомов HOOOH за счёт появления ещё одного акцепторного атома кислорода[12].
В 2005 году были получены первые вращательные спектры триоксида водорода, благодаря чему удалось установить точную геометрическую структуру этого полиоксида. Экспериментально определённые вращательные постоянные совпадают с расчётными и могут быть использованы для обнаружения триоксида водорода в атмосфере и межзвёздном пространстве (A0 = 51 149 МГц, B0 = 10 688 МГц, C0 = 9355 МГц)[12].
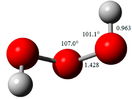
Строение
Долгое время строение HOOOH изучалось квантовохимическими методами ab initio различной сложности, а затем было подтверждено методом вращательной спектроскопии. Все данные свидетельствуют о том, что молекула триоксида водорода представляет собой зигзагообразную цепь, напоминающую винт, с группой симметрии С2 и одинаковыми двугранными углами HOOO, равными 81,8°. Дипольный момент не определён экспериментально, но расчёты дают значение 1,0 ± 0,1 Д, что ожидаемо меньше значений дипольных моментов для HOOH (1,572 Д) и HOH (1,847 Д). цис-Изомер триоксида водорода лишь ненамного менее устойчив (расчётное значение 2,5 ± 0,1 ккал/моль). Энергия перехода от цис- к транс-изомеру (вращение flip-flop, геминальный двойной ротор) оценивается в 3,3 и 2,9 ккал/моль, а энергия обратного перехода — в 5,7 и 5,3 ккал/моль. Таким образом, при комнатной температуре молекула HOOOH испытывает быстрое внутреннее вращение[13].
Разложение
Триоксид водорода разлагается в различных органических растворителях с образованием воды и синглетного кислорода O2 (1Δg). Последний можно детектировать при помощи специального акцептора — 9,10-диметилантрацена, образующего при этом 9,10-эндопероксид, либо по хемилюминесценции в инфракрасной области с максимумом при 1272 нм (ацетон, –10 °С). Было также обнаружено, что изотопная метка 17О, по крайней мере, частично переходит из триоксида водорода в образующуюся из него воду. Изучение кинетики реакции показало, что реакция разложения имеет псевдопервый порядок, а существенную роль выполняет комплексообразование с присутствующим в реакционной смеси избытком воды. Оценочное время полуразложения HOOOH при комнатной температуре в полярных органических растворителях составляет 16 ± 2 минуты, тогда как в воде это значение гораздо меньше и составляет 20 миллисекунд[14].
Реакционная способность
Очень немногое известно о реакционной способности триоксида водорода. Эксперименты с тиантрен-5-оксидом (химическим реагентом, позволяющим различить нуклеофильные и электрофильные окислители) показали, что триоксид водорода реагирует как электрофил, являясь даже более электрофильным, чем озон[15].
Окисление замещённых метилфенилсульфидов в ацетоне при –40 °С приводило к образованию соответствующих сульфоксидов. Перекись водорода в этих условиях, напротив, не вступала в реакцию с сульфидами[15].
Триоксид водорода также быстро реагирует с пиридином, диазабицикло[2.2.2]октеном и триэтиламином. Реакции протекают бурно даже при низких температурах и дают соответствующие N-оксиды[15].
Примечания
- ↑ Cerkovnik, Plesničar, 2013, p. 7930.
- ↑ Перейти обратно: 2,0 2,1 2,2 2,3 2,4 Cerkovnik, Plesničar, 2013, p. 7931.
- ↑ Czapski, Bielski, 1963.
- ↑ Cerkovnik, Plesničar, 2013, p. 7931—7933.
- ↑ Cerkovnik, Plesničar, 2013, p. 7932—7933.
- ↑ Перейти обратно: 6,0 6,1 Nyffeler et al., 2004.
- ↑ Cerkovnik, Plesničar, 2013, p. 7933.
- ↑ Перейти обратно: 8,0 8,1 Cerkovnik, Plesničar, 2013, p. 7934.
- ↑ Bergant et al., 2008.
- ↑ Engdahl, Nelander, 2002.
- ↑ Cerkovnik, Plesničar, 2013, p. 7936.
- ↑ Перейти обратно: 12,0 12,1 Cerkovnik, Plesničar, 2013, p. 7937.
- ↑ Cerkovnik, Plesničar, 2013, p. 7938.
- ↑ Cerkovnik, Plesničar, 2013, p. 7942.
- ↑ Перейти обратно: 15,0 15,1 15,2 Cerkovnik, Plesničar, 2013, p. 7945—7946.
Литература
Обзоры
- Cerkovnik J., Plesničar B. Recent Advances in the Chemistry of Hydrogen Trioxide (HOOOH) (англ.) // Chem. Rev. — 2013. — Vol. 113, no. 10. — P. 7930—7951. — doi:10.1021/cr300512s.
Оригинальные работы
- Bergant A., Cerkovnik J., Plesničar B., Tuttle T. An Efficient Methyltrioxorhenium(VII)-Catalyzed Transformation of Hydrotrioxides (ROOOH) into Dihydrogen Trioxide (HOOOH) (англ.) // J. Am. Chem. Soc. — 2008. — Vol. 130, no. 43. — P. 14086—14087. — doi:10.1021/ja806411a. — PMID 18834116.
- Czapski G., Bielski B. H. J. The formation and decay of H2O3 and HO2 in electron-irradiated aqueous solutions (англ.) // J. Phys. Chem. — 1963. — Vol. 67, no. 10. — P. 2180—2184. — doi:10.1021/j100804a050.
- Engdahl A., Nelander B. The Vibrational Spectrum of H2O3 (англ.) // Science. — 2002. — Vol. 295. — P. 482—483. — doi:10.1126/science.1067235. — PMID 11799239.
- Nyffeler P. T., Boyle N. A., Eltepu L., Wong C.-H., Eschenmoser A., Lerner R. A., Wentworth P. Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone (англ.) // Angew. Chem. Int. Ed. — 2004. — Vol. 43, no. 35. — P. 4656—4659. — doi:10.1002/anie.200460457. — PMID 15317003.