Нитрат свинца(II)
| Динитрат свинца | |
|---|---|
   | |
 | |
| Общие | |
| Систематическое наименование |
нитрат свинца(II) |
| Хим. формула | Pb(NO3)2 |
| Физические свойства | |
| Состояние | бесцветное вещество |
| Молярная масса | 331.2 г/моль |
| Плотность | (20 °C) 4,53 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | (разл.) 270 °C |
| • вспышки | негорюч °C |
| Химические свойства | |
| Растворимость | |
| • в воде |
(20 °C) 52 г/100мл (100 °C) 127 г/100 мл |
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим |
| Оптические свойства | |
| Показатель преломления | 1.782[1] |
| Структура | |
| Координационная геометрия | кубооктаэдрическая |
| Кристаллическая структура | гранецентрированная кубическая |
| Классификация | |
| Рег. номер CAS | 10099-74-8 |
| RTECS | OG2100000 |
| Номер ООН | 1469 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат свинца(II) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
История
Исторически первое промышленное применение нитрата свинца (II) — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром жёлтый» (хромат свинца(II)), «хром оранжевый» (гидроксид-хромат свинца(II)) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий[2].
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса[3].
Процесс производства был и остаётся химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835[4][5]. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединённых Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны[6].
Физические свойства
Нитрат свинца хорошо растворяется в воде (52,2 г/100 г воды) с поглощением тепла, плохо растворяется в этиловом и метиловом спиртах, ацетоне.
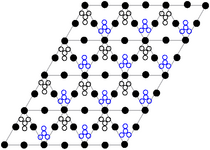
Кристаллическая структура
Кристаллическая структура твёрдого динитрата свинца была определена с помощью нейтронной дифракции[7][8]. Нитрат свинца образует бесцветные диамагнитные кристаллы, плотность 4,530 г/см³, кубическая сингония, пространственная группа Pa3, а = 0,784 нм, Z=4. Каждый атом свинца окружён двенадцатью атомами кислорода (длина связи 0,281 нм). Все длины N—O связей одинаковы — 0,127 нм.
Интерес исследователей к кристаллической структуре нитрата свинца был основан на предположении свободного вращения нитратных групп в кристаллической решётке при высоких температурах, но это не подтвердилось[8].
Кроме кубической разновидности нитрата свинца была получена моноклинная форма, которая плохо растворима в воде даже при нагревании.
Получение
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
- [math]\displaystyle{ \mathsf{3Pb + 8HNO_3 \longrightarrow 3Pb(NO_3)_2 + 2NO\uparrow + 4H_2O} }[/math]
- [math]\displaystyle{ \mathsf{PbO + 2HNO_3 \longrightarrow Pb(NO_3)_2 + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{Pb(OH)_2 + 2HNO_3 \longrightarrow Pb(NO_3)_2 + 2H_2O} }[/math]
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота[9].
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор[10]. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 \rightleftarrows Pb^{2+} + 2NO_3^- } }[/math]
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель рН от 3,0 до 4,0 для 20 % водного раствора[11]. При избытке ионов NO3− в растворе образуются нитратокомплексы [Pb(NO3)3]−, [Pb(NO3)4]2− и [Pb(NO3)6]4−. При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 + 2HCl \longrightarrow PbCl_2\downarrow + 2HNO_3} }[/math]
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 + H_2SO_4 \longrightarrow PbSO_4\downarrow + 2HNO_3} }[/math]
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 + 2NaOH \longrightarrow Pb(OH)_2\downarrow + 2NaNO_3} }[/math]
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 + 2NaN_3 \longrightarrow Pb(N_3)_2\downarrow + 2NaNO_3} }[/math]
Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид-анион, с образованием осадка оранжево-жёлтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь[12]:
- [math]\displaystyle{ \mathsf{Pb^{2+} + 2I^- \longrightarrow PbI_2\downarrow } }[/math]
Аналогичная реакция обмена проходит и в твёрдой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступке, происходит реакция:
- [math]\displaystyle{ \mathsf{Pb(NO_3)_2 + 2KI \longrightarrow PbI_2 + 2KNO_3 } }[/math]
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например, Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb2+-ион, который имеет стандартный редокс-потенциал (E0) −0.125 V, или нитрат-ион, который в кислой среде имеет (E0) +0.956 V[13] .
При нагревании кристаллов динитрата свинца они начинают разлагаться на оксид свинца(II), кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
- [math]\displaystyle{ \mathsf{2Pb(NO_3)_2 \longrightarrow 2PbO + 4NO_2 + O_2 } }[/math]
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике[14].
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдаётся предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках[15]. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида[6].
В лабораторной практике динитрат свинца используется как удобный и надёжный источник тетраоксида диазота.
Используется для синтеза азида свинца, инициирующего взрывчатого вещества.
Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота)[16][17].
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов[18]. Он также нашёл применение для получения изотиоцианатов из дитиокарбаматов[19]. Из-за своей токсичности он стал находить всё меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции[20].
Меры предосторожности
Динитрат свинца токсичен и канцерогенен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака[21]. Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приёме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца[22].
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака лёгких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка[21]. Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери[23].
Примечания
- ↑ Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds (неопр.). — McGraw-Hill Education, 2003. — С. 475. — ISBN 0070494398.
- ↑ Partington, James Riddick. A Text-book of Inorganic Chemistry (неопр.). — MacMillan, 1950. — С. 838.
- ↑ Libavius, Andreas. Alchemia Andreæ Libavii (неопр.). — Francofurti: Iohannes Saurius, 1595.
- ↑ Lead (недоступная ссылка). Encyclopædia Britannica Eleventh Edition. Архивировано 23 апреля 2012 года.
- ↑ Macgregor, John. Progress of America to year 1846 (неопр.). — London: Whittaker & Co, 1847. — ISBN 0665517912.
- ↑ Перейти обратно: 6,0 6,1 Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements (неопр.). — 2nd. — Oxford: Butterworth-Heinemann[англ.], 1997. — С. 388, 456. — ISBN 0-7506-3365-4.
- ↑ Hamilton, W.C. A neutron crystallographic study of lead nitrate (англ.) // Acta Cryst.[англ.]. — International Union of Crystallography, 1957. — Vol. 10. — P. 103—107. — doi:10.1107/S0365110X57000304.
- ↑ Перейти обратно: 8,0 8,1 Nowotny, H.; G. Heger. Structure refinement of lead nitrate (англ.) // Acta Cryst.[англ.]. — International Union of Crystallography, 1986. — Vol. C42. — P. 133—135. — doi:10.1107/S0108270186097032.
- ↑ Product catalog; other products (недоступная ссылка). Tilly, Belgium: Sidech. Архивировано 23 апреля 2012 года.
- ↑ Ferris, L.M. Lead nitrate—Nitric acid—Water system (неопр.) // Journal of Chemicals and Engineering Date. — 1959. — Т. 5. — С. 242. — doi:10.1021/je60007a002.
- ↑ MSDS — описание нитрата свинца (англ.) (недоступная ссылка)
- ↑ Adlam, George Henry Joseph; Price, Leslie Slater. A Higher School Certificate[англ.] Inorganic Chemistry (англ.). — London: John Murray, 1938.
- ↑ Hill, John W.; Petrucci, Ralph H. General Chemistry (неопр.). — 2nd. — Upper Saddle River, New Jersey: Prentice Hall, 1999. — С. 781. — ISBN 0-13-010318-7.
- ↑ Barkley, J.B. Lead nitrate as an oxidizer in blackpowder (неопр.) // Pyrotechnica. — Post Falls: Pyrotechnica Publications, 1978. — Октябрь (т. IV).
- ↑ Historical development of titanium dioxide (недоступная ссылка). Millennium Inorganic Chemicals. Архивировано 1 августа 2003 года.
- ↑ Habashi, Fathi. Recent advances in gold metallurgy (неопр.). — Quebec City, Canada: Laval University, 1998 (est). Архивированная копия (недоступная ссылка). Дата обращения: 21 апреля 2010. Архивировано 30 марта 2008 года.
- ↑ Auxiliary agents in gold cyanidation (недоступная ссылка). Gold Prospecting and Gold Mining. Архивировано 23 апреля 2012 года.
- ↑ Schulze, K. E. Über α- und β-Methylnaphtalin (неопр.) // Berichte der deutschen chemischen Gesellschaft[англ.]. — 1884. — Т. 17. — С. 1530. — doi:10.1002/cber.188401701384.
- ↑ Dains, F. B.; Brewster, R. Q.; Olander, C. P. Phenyl isothiocyanate 1, 447 страниц
- ↑ Rapoport, H.; Jamison, T. (1998), «(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate» Архивная копия от 6 июня 2011 на Wayback Machine, Орг.синтез; 344 страницы
- ↑ Перейти обратно: 21,0 21,1 World Health Organization, International Agency for Research on Cancer. Inorganic and Organic Lead Compounds (PDF) (недоступная ссылка). International Agency for Research on Cancer (2006). Архивировано 23 апреля 2012 года.
- ↑ Lead nitrate, International Chemical Safety Card 1000. International Labour Organization, International Occupational Safety and Health Information Centre (March 1999). Архивировано 23 апреля 2012 года.
- ↑ Mohammed-Brahim, B.; J.P. Buchet, R. Lauwerys. Erythrocyte pyrimidine 5'-nucleotidase activity in workers exposed to lead, mercury or cadmium (англ.) // Int Arch Occup Environ Health[англ.] : journal. — 1985. — Vol. 55, no. 3. — P. 247—252. — doi:10.1007/BF00383757. — PMID 2987134.

