Карбонат рубидия
Внешний вид
| Карбонат рубидия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Карбонат рубидия |
| Традиционные названия | Углекислый рубидий |
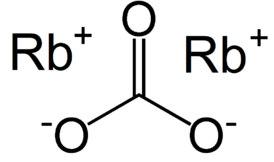
| Хим. формула | Rb2CO3 |
| Физические свойства | |
| Молярная масса | 230,94 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 873 °C |
| Мол. теплоёмк. | 117,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1132,5 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 22320; 301,150 г/100 мл |
| • в этаноле | 0,7 г/100 мл |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карбонат рубидия (углекислый рубидий) — соль щелочного металла рубидия и угольной кислоты с химической формулой Rb2CO3. Белые гигроскопические кристаллы.
Получение
- Взаимодействие надпероксида рубидия с оксидами углерода:
- [math]\displaystyle{ \mathsf{4\ RbO_2 + 2\ CO_2 \ \xrightarrow{\ }\ 2\ Rb_2CO_3 + 3\ O_2 } }[/math]
- [math]\displaystyle{ \mathsf{2RbO_2 + CO \ \xrightarrow{\ }\ Rb_2CO_3 + O_2 } }[/math]
- Пропуская углекислый газ через гидроксид рубидия:
- [math]\displaystyle{ \mathsf{2\ RbOH + CO_2 \ \xrightarrow{\ }\ Rb_2CO_3 + H_2O } }[/math]
Физические свойства
Карбонат рубидия представляет собой бесцветные гигроскопические кристаллы моноклинной сингонии. При температуре 303°С переходит в гексагональную фазу.
Очень хорошо растворяется в воде, раствор имеет сильнощелочную реакцию.
Образует несколько кристаллогидратов: Rb2CO3•9H2O, Rb2CO3•8H2O, Rb2CO3•1,5H2O, Rb2CO3•0,5H2O.
Химические свойства
- При нагревании в вакууме карбонат рубидия разлагается до оксида:
- [math]\displaystyle{ \mathsf{ Rb_2CO_3 \ \xrightarrow{900^oC}\ Rb_2O + CO_2 } }[/math]
- Реагирует с кислотами:
- [math]\displaystyle{ \mathsf{Rb_2CO_3 + 2\ HCl \ \xrightarrow{\ }\ 2\ RbCl + CO_2\uparrow + H_2O } }[/math]
- Во влажном воздухе медленно взаимодействует с углекислым газом (гидрокарбонат рубидия):
- [math]\displaystyle{ \mathsf{Rb_2CO_3 + H_2O + CO_2 \ \stackrel{\xrightarrow{20^oC}}{\xleftarrow[170^oC]{}}\ 2\ RbHCO_3 } }[/math]
- С насыщенным раствором гидроксида кальция образует гидроксид рубидия, что используется для получения последнего[1]:
- [math]\displaystyle{ \mathsf{Rb_2CO_3 + Ca(OH)_2 \xrightarrow{} 2RbOH + CaCO_3\downarrow } }[/math]
Примечания
- ↑ Лидин, 2000, с. 43.
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 408 с.