Вязкость

Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. В результате макроскопическая работа, затрачиваемая на это перемещение, рассеивается в виде тепла. Твёрдые тела (стекло, металлы, полупроводники, диэлектрики, ферромагнетики)[1] также могут обладать вязкостью, но внутреннее трение в твёрдых телах в силу специфики явления обычно рассматривается отдельно в теории упругости и пластичности.
Механизм внутреннего трения в жидкостях и газах заключается в том, что движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Вязкость газов и жидкостей характеризуют динамическим коэффициентом вязкости (единица измерения в Международной системе единиц (СИ) — паскаль-секунда, Па·с, в системе СГС — пуаз, П; 1 Па·с = 10 П, 1 сП = 10−3 Па·с = 1 мПа·с) или кинематическим коэффициентом вязкости (единица измерения в СИ — м2/c, в СГС — стокс, Ст; 1 Ст = см2/с = 10−4 м2/с, 1 сСт = 1 мм2/с = 10−6 м2/с; внесистемная единица — градус Энглера). Кинематический коэффициент вязкости — отношение динамического коэффициента к плотности вещества. Классические методы измерения вязкости включают, например, измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести. Прибор для измерения вязкости называется вискозиметром.
Переход вещества из жидкого состояния в стеклообразное обычно связывают с достижением вязкости порядка 1011—1012 Па·с.
Сила вязкого трения
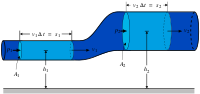
Если параллельные плоские тела площадью S каждое, находящиеся на малом расстоянии h, движутся в той же плоскости со скоростью [math]\displaystyle{ \vec{v} }[/math] друг относительно друга, а пространство между телами заполнено жидкостью или газом, то на каждое из них действует сила, в простейшем случае пропорциональная относительной скорости [math]\displaystyle{ \vec{v} }[/math] и площади S и обратно пропорциональная расстоянию между телами h:
- [math]\displaystyle{ \vec{F} \sim -\frac{\vec{v} \cdot S}{h}. }[/math]
Коэффициент пропорциональности, зависящий от природы жидкости или газа, называют коэффициентом динамической вязкости. Этот закон был предложен Исааком Ньютоном в 1687 году и носит его имя (закон вязкости Ньютона). Экспериментальное подтверждение закона было получено в начале XIX века в опытах Кулона с крутильными весами и в экспериментах Хагена и Пуазёйля с течением воды в капиллярах[2].
Эта сила называется силой вязкого трения. Её качественное отличие от сухого трения, кроме прочего, в том, что она пропорциональна скорости. Следовательно, при наличии только вязкого трения и сколь угодно малой внешней силы тело обязательно придёт в движение, то есть для вязкого трения не существует трения покоя.
Вторая вязкость
Вторая вязкость, или объёмная вязкость, — внутреннее трение при переносе импульса в направлении движения. Влияет только при учёте сжимаемости и (или) при учёте неоднородности коэффициента второй вязкости по пространству.
Если динамическая (и кинематическая) вязкость характеризует деформацию чистого сдвига, то вторая вязкость характеризует деформацию объёмного сжатия.
Объёмная вязкость играет большую роль в затухании звука и ударных волн и экспериментально определяется путём измерения этого затухания.
Вязкость газов
В кинетической теории газов коэффициент внутреннего трения вычисляется по формуле
- [math]\displaystyle{ \eta = \frac{1}{3} \langle u \rangle \langle \lambda \rangle \rho, }[/math]
где [math]\displaystyle{ \langle u \rangle }[/math] — средняя скорость теплового движения молекул, [math]\displaystyle{ \langle \lambda \rangle }[/math] − средняя длина свободного пробега. Из этого выражения в частности следует, что вязкость не очень разреженных газов практически не зависит от давления, поскольку плотность [math]\displaystyle{ \rho }[/math] прямо пропорциональна давлению, а длина пробега [math]\displaystyle{ \langle \lambda \rangle }[/math] — обратно пропорциональна. Такой же вывод следует и для других кинетических коэффициентов для газов, например, для коэффициента теплопроводности. Однако этот вывод справедлив только до тех пор, пока разрежение газа не становится столь малым, что отношение длины свободного пробега к линейным размерам сосуда (число Кнудсена) не становится по порядку величины равным единице; в частности, это имеет место в сосудах Дьюара (термосах).
С повышением температуры вязкость большинства газов увеличивается, это объясняется увеличением средней скорости молекул газа [math]\displaystyle{ u }[/math], растущей с температурой как [math]\displaystyle{ \sqrt{T} }[/math].
Влияние температуры на вязкость газов
В отличие от жидкостей, вязкость газов увеличивается с увеличением температуры (у жидкостей она уменьшается при увеличении температуры).
Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:[3]
- [math]\displaystyle{ \mu = \mu_0 \frac{T_0 + C}{T + C} \left(\frac{T}{T_0}\right)^{3/2}, }[/math]
где
- μ — динамическая вязкость (в Па·с) при заданной температуре T;
- μ0 — контрольная вязкость (в Па·с) при некоторой контрольной температуре T0;
- T — заданная температура в кельвинах;
- T0 — контрольная температура в кельвинах;
- C — постоянная Сазерленда для того газа, вязкость которого требуется определить.
Эту формулу можно применять для температур в диапазоне 0 < T < 555 K и при давлениях менее 3,45 МПа с ошибкой менее 10 %, обусловленной зависимостью вязкости от давления.
Постоянная Сазерленда и контрольные вязкости газов при различных температурах приведены в таблице ниже:
| Газ | C, K | T0, K | μ0, мкПа·с |
|---|---|---|---|
| Воздух | 120 | 291,15 | 18,27 |
| Азот | 111 | 300,55 | 17,81 |
| Кислород | 127 | 292,25 | 20,18 |
| Углекислый газ | 240 | 293,15 | 14,8 |
| Угарный газ | 118 | 288,15 | 17,2 |
| Водород | 72 | 293,85 | 8,76 |
| Аммиак | 370 | 293,15 | 9,82 |
| Оксид серы(IV) | 416 | 293,65 | 12,54 |
| Гелий | 79,4[4] | 273 | 19[5] |
Вязкость жидкостей
Динамическая вязкость
Внутреннее трение жидкостей, как и газов, возникает при движении жидкости вследствие переноса импульса в направлении, перпендикулярном к направлению движения. Для так называемых ньютоновских жидкостей (которых вокруг нас большинство) справедлив общий закон внутреннего трения — закон Ньютона:
- [math]\displaystyle{ \tau = -\eta \frac{\partial v}{\partial n}. }[/math]
Коэффициент вязкости [math]\displaystyle{ \eta }[/math] (коэффициент динамической вязкости, динамическая вязкость) может быть получен на основе соображений о движениях молекул. Очевидно, что [math]\displaystyle{ \eta }[/math] будет тем меньше, чем меньше время t «оседлости» молекул. Эти соображения приводят к выражению для коэффициента вязкости, называемому уравнением Френкеля — Андраде:
- [math]\displaystyle{ \eta = C e^{w/kT}. }[/math]
Иная формула, представляющая коэффициент вязкости, была предложена Бачинским[6]. Как показано, коэффициент вязкости определяется межмолекулярными силами, зависящими от среднего расстояния между молекулами; последнее определяется молярным объёмом вещества [math]\displaystyle{ V_M }[/math]. Многочисленные эксперименты показали, что между молярным объёмом и коэффициентом вязкости существует соотношение
- [math]\displaystyle{ \eta = \frac{c}{V_M - V_C}, }[/math]
где:
- [math]\displaystyle{ c }[/math] — константа, характерная для определенной жидкости;
- [math]\displaystyle{ V_C }[/math] — собственный объём, занимаемый частицами жидкости.
Динамическая вязкость жидкостей уменьшается с увеличением температуры и растёт с увеличением давления.
Кинематическая вязкость
В технике, в частности, при расчёте гидроприводов и в триботехнике, часто приходится иметь дело с величиной
- [math]\displaystyle{ \nu = \frac{\eta}{\rho}, }[/math]
и эта величина получила название кинематической вязкости[7].
Здесь [math]\displaystyle{ \rho }[/math] — плотность жидкости; [math]\displaystyle{ \eta }[/math] — коэффициент динамической вязкости.
Кинематическая вязкость в старых источниках часто указана в сантистоксах (сСт). В СИ эта величина переводится следующим образом: 1 сСт = 1 мм2/c = 10−6 м2/c.
Условная вязкость
Условная вязкость — величина, косвенно характеризующая гидравлическое сопротивление течению, измеряемая временем истечения заданного объёма раствора через вертикальную трубку (определённого диаметра). Измеряют в градусах Энглера (по имени немецкого химика К. О. Энглера), обозначают — °ВУ. Определяется отношением времени истечения 200 мл испытываемой жидкости при данной температуре из специального вискозиметра ко времени истечения 200 мл дистиллированной воды из того же прибора при 20 °С. Условную вязкость до 16 °ВУ переводят в кинематическую по таблице ГОСТ, а условную вязкость, превышающую 16 °ВУ, по формуле
- [math]\displaystyle{ \nu = 7,4 \cdot 10^{-6} E_t, }[/math]
где [math]\displaystyle{ \nu }[/math] — кинематическая вязкость (в м2/с), а [math]\displaystyle{ E_t }[/math] — условная вязкость (в °ВУ) при температуре t.
Ньютоновские и неньютоновские жидкости
Ньютоновскими называют жидкости, для которых вязкость не зависит от скорости деформации. В уравнении Навье — Стокса для ньютоновской жидкости имеет место аналогичный вышеприведённому закон вязкости (по сути, обобщение закона Ньютона, или закон Навье — Стокса[8]):
- [math]\displaystyle{ \sigma_{ij} = \eta \left(\frac{\partial v_i}{\partial x_j} + \frac{\partial v_j}{\partial x_i}\right), }[/math]
где [math]\displaystyle{ \sigma_{ij} }[/math] — тензор вязких напряжений.
Среди неньютоновских жидкостей по зависимости вязкости от скорости деформации различают псевдопластики и дилатантные жидкости. Моделью с ненулевым напряжением сдвига (действие вязкости подобно сухому трению) является модель Бингама. Если вязкость меняется с течением времени, жидкость называется тиксотропной. Для неньютоновских жидкостей методика измерения вязкости получает первостепенное значение.
С повышением температуры вязкость многих жидкостей падает. Это объясняется тем, что кинетическая энергия каждой молекулы возрастает быстрее, чем потенциальная энергия взаимодействия между ними. Поэтому все смазки всегда стараются охладить, иначе это грозит простой утечкой через узлы.[источник не указан 1541 день]
Вязкость аморфных материалов
Вязкость аморфных материалов (например, стекла или расплавов) — это термически активизируемый процесс[9]:
- [math]\displaystyle{ \eta(T) = A \exp\left(\frac{Q}{R T}\right), }[/math]
где
- [math]\displaystyle{ Q }[/math] — энергия активации вязкости (Дж/моль);
- [math]\displaystyle{ T }[/math] — температура (К);
- [math]\displaystyle{ R }[/math] — универсальная газовая постоянная (8,31 Дж/моль·К);
- [math]\displaystyle{ A }[/math] — некоторая постоянная.
Вязкое течение в аморфных материалах характеризуется отклонением от закона Аррениуса: энергия активации вязкости [math]\displaystyle{ Q }[/math] изменяется от большой величины [math]\displaystyle{ Q_H }[/math] при низких температурах (в стеклообразном состоянии) на малую величину [math]\displaystyle{ Q_L }[/math] при высоких температурах (в жидкообразном состоянии). В зависимости от этого изменения аморфные материалы классифицируются либо как сильные, когда [math]\displaystyle{ (Q_H - Q_L) \lt Q_L }[/math], или ломкие, когда [math]\displaystyle{ (Q_H - Q_L) \geqslant Q_L }[/math]. Ломкость аморфных материалов численно характеризуется параметром ломкости Доримуса [math]\displaystyle{ R_D = \frac{Q_H}{Q_L} }[/math]: сильные материалы имеют [math]\displaystyle{ R_D \lt 2 }[/math], в то время как ломкие материалы имеют [math]\displaystyle{ R_D \geqslant 2 }[/math].
Вязкость аморфных материалов весьма точно аппроксимируется двуэкспоненциальным уравнением[10]
- [math]\displaystyle{ \eta(T) = A_1 T \left(1 + A_2 \exp\frac{B}{R T}\right) \left(1 + C \exp\frac{D}{R T}\right) }[/math]
с постоянными [math]\displaystyle{ A_1 }[/math], [math]\displaystyle{ A_2 }[/math], [math]\displaystyle{ B }[/math], [math]\displaystyle{ C }[/math] и [math]\displaystyle{ D }[/math], связанными с термодинамическими параметрами соединительных связей аморфных материалов.
В узких температурных интервалах недалеко от температуры стеклования [math]\displaystyle{ T_g }[/math] это уравнение аппроксимируется формулами типа VTF или сжатыми экспонентами Кольрауша.

Если температура существенно ниже температуры стеклования, [math]\displaystyle{ T \lt T_g }[/math], двуэкспоненциальное уравнение вязкости сводится к уравнению типа Аррениуса
- [math]\displaystyle{ \eta(T) = A_L T \exp\left(\frac{Q_H}{R T}\right) }[/math]
с высокой энергией активации [math]\displaystyle{ Q_H = H_d + H_m }[/math], где [math]\displaystyle{ H_d }[/math] — энтальпия разрыва соединительных связей, то есть создания конфигуронов, а [math]\displaystyle{ H_m }[/math] — энтальпия их движения. Это связано с тем, что при [math]\displaystyle{ T \lt T_g }[/math] аморфные материалы находятся в стеклообразном состоянии и имеют подавляющее большинство соединительных связей неразрушенными.
При [math]\displaystyle{ T \gg T_g }[/math] двуэкспоненциальное уравнение вязкости также сводится к уравнению типа Аррениуса
- [math]\displaystyle{ \eta(T) = A_H T \exp\left(\frac{Q_L}{R T}\right), }[/math]
но с низкой энергией активации [math]\displaystyle{ Q_L = H_m }[/math]. Это связано с тем, что при [math]\displaystyle{ T \gg T_g }[/math] аморфные материалы находятся в расправленном состоянии и имеют подавляющее большинство соединительных связей разрушенными, что облегчает текучесть материала.
Относительная вязкость
В технических науках часто пользуются понятием относительной вязкости, под которой понимают отношение коэффициента динамической вязкости (см. выше) раствора к коэффициенту динамической вязкости чистого растворителя:
- [math]\displaystyle{ \mu_r = \frac{\mu}{\mu_0}, }[/math]
где
- μ — динамическая вязкость раствора;
- μ0 — динамическая вязкость растворителя.
Вязкость некоторых веществ
Для авиастроения и судостроения наиболее важно знать вязкости воздуха и воды.
Вязкость воздуха

Вязкость воздуха зависит в основном от температуры. При 15,0 °C вязкость воздуха составляет 1,78⋅10−5 кг/(м·с) = 17,8 мкПа·с = 1,78⋅10−5 Па·с. Можно найти вязкость воздуха как функцию температуры с помощью программ расчёта вязкостей газов[11].
Вязкость воды
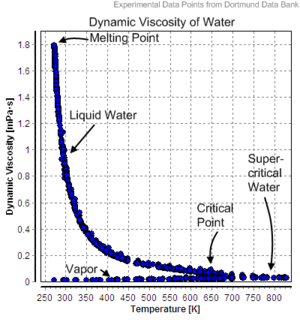
Динамическая вязкость воды составляет 8,90·10−4 Па·с при температуре около 25 °C. Как функция температуры: T = A × 10B/(T−C), где A = 2,414·10−5 Па·с, B = 247,8 K, C = 140 K.
Значения динамической вязкости жидкой воды при разных температурах вплоть до точки кипения приведены в таблице:
| Температура, °C | Вязкость, мПа·с |
|---|---|
| 10 | 1,308 |
| 20 | 1,002 |
| 30 | 0,7978 |
| 40 | 0,6531 |
| 50 | 0,5471 |
| 60 | 0,4668 |
| 70 | 0,4044 |
| 80 | 0,3550 |
| 90 | 0,3150 |
| 100 | 0,2822 |
Динамическая вязкость разных веществ
Ниже приведены значения коэффициента динамической вязкости некоторых ньютоновских жидкостей:
| Газ | при 0 °C (273 K), мкПа·с | при 27 °C (300 K), мкПа·с |
|---|---|---|
| воздух | 17,4 | 18,6 |
| водород | 8,4 | 9,0 |
| гелий | 20,0 | |
| аргон | 22,9 | |
| ксенон | 21,2 | 23,2 |
| углекислый газ | 15,0 | |
| метан | 11,2 | |
| этан | 9,5 |
| Жидкость | Вязкость, Па·с | Вязкость, мПа·с |
|---|---|---|
| ацетон | 3,06·10−4 | 0,306 |
| бензол | 6,04·10−4 | 0,604 |
| кровь (при 37 °C) | (3—4)·10−3 | 3—4 |
| касторовое масло | 0,985 | 985 |
| кукурузный сироп | 1,3806 | 1380,6 |
| этиловый спирт | 1.074·10−3 | 1.074 |
| этиленгликоль | 1,61·10−2 | 16,1 |
| глицерин (при 20 °C) | 1,49 | 1490 |
| мазут | 2,022 | 2022 |
| ртуть | 1,526·10−3 | 1,526 |
| метиловый спирт | 5,44·10−4 | 0,544 |
| моторное масло SAE 10 (при 20 °C) | 0,065 | 65 |
| моторное масло SAE 40 (при 20 °C) | 0,319 | 319 |
| нитробензол | 1,863·10−3 | 1,863 |
| жидкий азот (при 77K) | 1,58·10−4 | 0,158 |
| пропанол | 1,945·10−3 | 1,945 |
| оливковое масло | 0,081 | 81 |
| пек | 2,3·108 | 2,3·1011 |
| серная кислота | 2,42·10−2 | 24,2 |
| вода | 8,94·10−4 | 0,894 |
Примечания
- ↑ Внутреннее трение в металлах, полупроводниках, диэлектриках и ферромагнетиках: Сб. статей / Под ред. Ф. Н. Тавадзе. — М.: Наука, 1978. — 235 с.
- ↑ О некоторых ошибках в курсах гидродинамики Архивная копия от 22 декабря 2015 на Wayback Machine, с. 3—4.
- ↑ Alexander J. Smits, Jean-Paul Dussauge Turbulent shear layers in supersonic flow Архивная копия от 17 июля 2017 на Wayback Machine. — Birkhäuser, 2006. — P. 46. — ISBN 0-387-26140-0.
- ↑ Data constants for Sutherland’s formula Архивная копия от 6 марта 2018 на Wayback Machine.
- ↑ Viscosity of liquids and gases Архивная копия от 3 октября 2017 на Wayback Machine.
- ↑ Хмельницкий Р. А. Физическая и коллоидная химия: Учебних для сельскохозяйственных спец. вузов. — М.: Высшая школа, 1988. — С. 40. — 400 с. — ISBN 5-06-001257-3.
- ↑ Попов Д. Н. Динамика и регулирование гидро- и превмосистем : Учеб. для машиностроительных вузов. — М. : Машиностроение, 176. — С. 175. — 424 с.
- ↑ Седов Л. И. Механика сплошной среды Архивная копия от 28 ноября 2014 на Wayback Machine. Т. 1. — М.: Наука, 1970. — С. 166.
- ↑ Френкель Я. И. Кинетическая теория жидкостей. — Ленинград, Наука, 1975. — с. 226.
- ↑ Ojovan M. Viscous flow and the viscosity of melts and glasses. Physics and Chemistry of Glasses, 53 (4) 143—150 (2012).
- ↑ Gas Viscosity Calculator Архивная копия от 21 июля 2011 на Wayback Machine.
См. также
- Уравнения Навье — Стокса
- Закон вязкого трения Ньютона
- Течение Пуазёйля
- Степенной закон вязкости жидкостей
- Тиксотропия
- Реопексия
- Псевдопластичность
- Текучесть
- Вязкоупругость
- Индекс вязкости
- Гидратация
Литература
- R. H. Doremus. J. Appl. Phys., 92, 7619—7629 (2002).
- M. I. Ojovan, W. E. Lee. J. Appl. Phys., 95, 3803—3810 (2004).
- M. I. Ojovan, K. P. Travis, R. J. Hand. J. Phys.: Condensed Matter, 19, 415107 (2007).
- Л. И. Седов. Механика сплошной среды. Т. 1. — М.: Наука, 1970. — 492 с.
- П. Н. Гедык, М. И. Калашникова. Смазка металлургического оборудования. — М.: Металлургия, 1976. — 380 с.
- И. Ф. Голубев. Вязкость газов и газовых смесей. — М.: Физматлит, 1959.
- Ред. Ф. Н. Тавадзе Внутреннее трение в металлах, полупроводниках, диэлектриках и ферромагнетиках. — М., Наука, 1978. — 235 c.
Ссылки
- Аринштейн А. Сравнительный вискозиметр Жуковского // Квант, № 9, 1983.
- Измерение вязкости нефтепродуктов
- Булкин П. С. Попова И. И., Общий физический практикум. Молекулярная физика
- Градус условной вязкости // Большой энциклопедический политехнический словарь. — 2004.
- Вязкость воды
В статье не хватает ссылок на источники (см. также рекомендации по поиску). |
Для улучшения этой статьи желательно: |