Рибонуклеиновая кислота
Рибонуклеи́новая кислота́ (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов и играют важную роль в кодировании, прочтении, регуляции и выражении генов.
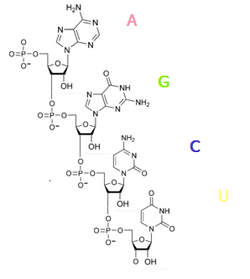
Так же, как ДНК (дезоксирибонуклеиновая кислота), РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией. Трансляция — это синтез белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
Для одноцепочечных РНК характерны разнообразные пространственные структуры, в которых часть нуклеотидов одной и той же цепи спарены между собой. Некоторые высокоструктурированные РНК принимают участие в синтезе белка клетки, например, транспортные РНК служат для узнавания кодонов и доставки соответствующих аминокислот к месту синтеза белка, а рибосомные РНК служат структурной и каталитической основой рибосом.
Однако функции РНК в современных клетках не ограничиваются их ролью в трансляции. Так, малые ядерные РНК принимают участие в сплайсинге эукариотических матричных РНК и других процессах.
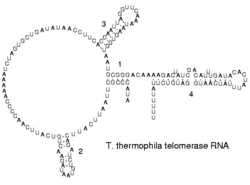
Помимо того, что молекулы РНК входят в состав некоторых ферментов (например, теломеразы), у отдельных РНК обнаружена собственная ферментативная активность: способность вносить разрывы в другие молекулы РНК или, наоборот, «склеивать» два РНК-фрагмента. Такие РНК называются рибозимами.
Геномы ряда вирусов состоят из РНК, то есть у них она играет роль, которую у высших организмов выполняет ДНК. На основании разнообразия функций РНК в клетке была выдвинута гипотеза, согласно которой РНК — первая молекула, которая была способна к самовоспроизведению в добиологических системах.
История изучения
Нуклеиновые кислоты были открыты в 1868 году швейцарским учёным Иоганном Фридрихом Мишером, который назвал эти вещества «нуклеин», поскольку они были обнаружены в ядре (лат. nucleus)[1]. Позже было обнаружено, что бактериальные клетки, в которых нет ядра, тоже содержат нуклеиновые кислоты. Значение РНК в синтезе белков было предположено в 1939 году в работе Торбьёрна Оскара Касперссона, Жана Браше и Джека Шульца[2]. Джерард Маирбакс выделил первую матричную РНК, кодирующую гемоглобин кролика и показал, что при её введении в ооциты образуется тот же самый белок[3]. В 1956—1957 годах А. Белозёрским, А. Спириным, Э. Волкиным, Л. Астраханом проводились работы по определению состава РНК клеток, которые привели к выводу, что основную массу РНК в клетке составляет рибосомальная РНК[4]. Северо Очоа получил Нобелевскую премию по медицине в 1959 году за открытие механизма синтеза РНК[5].
В 1961 году советские учёные Г. П. Георгиев и В. Л. Мантьева открыли в ядрах клеток животных ядерную РНК, из которой образуется матричная РНК[6]. В октябре 1961 года было зарегистрировано Научное открытие № 145 «Явление синтеза ДРНК (рибонуклеиновой кислоты нового класса) в ядрах клеток высших организмов»[7]. Ими было установлено неизвестное ранее явление образования в ядрах клеток высших организмов рибонуклеиновой кислоты нового класса — ядерной дРНК (РНК с ДНК-подобным нуклеотидным составом), являющейся высокомолекулярным предшественником информационной РНК, которая несет генетическую информацию для синтеза клеточных белков.
Последовательность 77 нуклеотидов одной из тРНК дрожжей S. cerevisiae была определена в 1965 году в лаборатории Роберта Холли, за что в 1968 году он получил Нобелевскую премию по медицине[8]. В 1967 Карл Вёзе предположил, что РНК обладают каталитическими свойствами. Он выдвинул так называемую гипотезу мира РНК, в котором РНК прото-организмов служила и в качестве молекулы хранения информации (сейчас эта роль выполняется в основном ДНК) и молекулы, которая катализировала метаболические реакции (сейчас это делают в основном ферменты)[9]. В 1976 Уолтер Фаэрс и его группа в Гентском Университете в Бельгии определили первую последовательность генома РНК-содержащего вируса, бактериофага MS2[10]. В начале 1990-х было обнаружено, что введение чужеродных генов в геном растений приводит к подавлению выражения аналогичных генов растения[11]. Приблизительно в это же время было показано, что РНК длиной около 22 оснований, которые сейчас называются микроРНК, играют регуляторную роль в онтогенезе нематод C. elegans[12].
Происхождение названия
Основоположник химии сахаров Эмиль Фишер в конце 1880-х вместе со своим молодым коллегой Оскаром Пилоти из арабоновой кислоты получил неизвестную ранее кислоту, изомерную арабоновой. Авторы, придумывая название новому веществу, сначала «изомеризировали» название исходной арабоновой кислоты, переставив в ней буквы. Получилась «раабоновая», но им не понравилось, как это звучит, и они заменили аа на и. Получилась рибоновая кислота, из которой восстановлением была получена рибоза. А она уже дала название таким соединениям, как рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК), рибосома, моносахарид рибулоза, спирт рибит, фермент рибонуклеаза и т. д.[13][страница не указана 2004 дня]
Химический состав и модификации мономеров
Нуклеотиды РНК состоят из сахара — рибозы, к которой в положении 1' присоединено одно из оснований: аденин, гуанин, цитозин или урацил. Фосфатная группа соединяет рибозы в цепочку, образуя связи с 3' атомом углерода одной рибозы и в 5' положении другой. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК — полианион. РНК транскрибируется как полимер четырёх оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C), но в «зрелой» РНК есть много модифицированных оснований и сахаров[14]. Всего в РНК насчитывается около 100 разных видов модифицированных нуклеотидов, из которых 2'-О-метилрибоза наиболее частая модификация сахара, а псевдоуридин — наиболее часто встречающееся модифицированное основание[15].
У псевдоуридина (Ψ) связь между урацилом и рибозой не C — N, а C — C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционирования тРНК[16]. Другое заслуживающее внимания модифицированное основание — гипоксантин, дезаминированный аденин, нуклеозид которого носит название инозина. Инозин играет важную роль в обеспечении вырожденности генетического кода.
Роль многих других модификаций не до конца изучена, но в рибосомальной РНК многие пост-транскрипционные модификации находятся в важных для функционирования рибосомы участках. Например, на одном из рибонуклеотидов, участвующем в образовании пептидной связи[17].
Структура
Азотистые основания в составе РНК могут образовывать водородные связи между цитозином и гуанином, аденином и урацилом, а также между гуанином и урацилом[18]. Однако возможны и другие взаимодействия, например, несколько аденинов могут образовывать петлю, или петля, состоящая из четырёх нуклеотидов, в которой есть пара оснований аденин — гуанин[19].
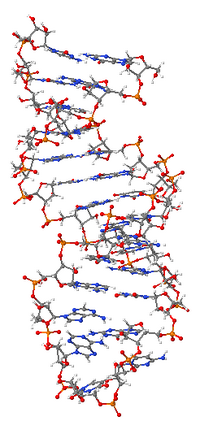
Важная структурная особенность РНК, отличающая её от ДНК — наличие гидроксильной группы в 2' положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, наиболее часто наблюдаемой у ДНК[20]. У А-формы глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка[21]. Второе последствие наличия 2' гидроксильной группы состоит в том, что конформационно пластичные, то есть не принимающие участие в образовании двойной спирали, участки молекулы РНК могут химически атаковать другие фосфатные связи и их расщеплять[22].
«Рабочая» форма одноцепочечной молекулы РНК, как и у белков, часто обладает третичной структурой. Третичная структура образуется на основе элементов вторичной структуры, образуемой с помощью водородных связей внутри одной молекулы. Различают несколько типов элементов вторичной структуры — стебель-петли, петли и псевдоузлы[23]. В силу большого числа возможных вариантов спаривания оснований предсказание вторичной структуры РНК — гораздо более сложная задача, чем предсказание вторичной структуры белков, но в настоящее время есть эффективные программы, например, mfold[24].
Примером зависимости функции молекул РНК от их вторичной структуры являются участки внутренней посадки рибосомы (IRES). IRES — структура на 5' конце информационной РНК, которая обеспечивает присоединение рибосомы в обход обычного механизма инициации синтеза белка, требующего наличия особого модифицированного основания (кэпа) на 5' конце и белковых факторов инициации. Первоначально IRES были обнаружены в вирусных РНК, но сейчас накапливается всё больше данных о том, что клеточные мРНК также используют IRES-зависимый механизм инициации в условиях стресса[25].
Многие типы РНК, например, рРНК и мяРНК в клетке функционируют в виде комплексов с белками, которые ассоциируют с молекулами РНК после их синтеза или (у эукариот) экспорта из ядра в цитоплазму. Такие РНК-белковые комплексы называются рибонуклеопротеиновыми комплексами или рибонуклеопротеидами.
Сравнение с ДНК
Между ДНК и РНК есть три основных отличия:
- ДНК содержит сахар дезоксирибозу, РНК — рибозу, у которой есть дополнительная, по сравнению с дезоксирибозой, гидроксильная группа. Эта группа увеличивает вероятность гидролиза молекулы, то есть уменьшает стабильность молекулы РНК.
- Азотистное основание, комплементарное аденину, в РНК не тимин, как в ДНК, а урацил — неметилированная форма тимина.
- ДНК существует в форме двойной спирали, состоящей из двух отдельных молекул. Молекулы РНК, в среднем, гораздо короче и преимущественно одноцепочечные.
Структурный анализ биологически активных молекул РНК, включая тРНК, рРНК, мяРНК и другие молекулы, которые не кодируют белков, показал, что они состоят не из одной длинной спирали, а из многочисленных коротких спиралей, расположенных близко друг к другу и образующих нечто, похожее на третичную структуру белка. В результате этого РНК может катализировать химические реакции, например, пептидил-трансферазный центр рибосомы, участвующий в образовании пептидной связи белков, полностью состоит из РНК[26][27].
Синтез
Синтез РНК в живой клетке проводится ферментом — РНК-полимеразой. У эукариот разные типы РНК синтезируются разными, специализированными РНК-полимеразами. В целом матрицей синтеза РНК может выступать как ДНК, так и другая молекула РНК. Например, полиовирусы используют РНК-зависимую РНК-полимеразу для репликации своего генетического материала, состоящего из РНК[28]. Но РНК-зависимый синтез РНК, который раньше считался характерным только для вирусов, происходит и в клеточных организмах, в процессе так называемой РНК-интерференции[29].
Как в случае ДНК-зависимой РНК-полимеразы, так и в случае РНК-зависимой РНК-полимеразы фермент присоединяется к промоторной последовательности. Вторичная структура молекулы матрицы расплетается с помощью хеликазной активности полимеразы, которая при движении субстрата в направлении от 3' к 5' концу молекулы синтезирует РНК в направлении 5' → 3'. Терминатор транскрипции в исходной молекуле определяет окончание синтеза. Многие молекулы РНК синтезируются в качестве молекул-предшественников, которые подвергаются «редактированию» — удалению ненужных частей с помощью РНК-белковых комплексов[30].
Например, у кишечной палочки гены рРНК расположены в составе одного оперона (в rrnB порядок расположения такой: 16S — tRNAGlu 2 — 23S —5S) считываются в виде одной длинной молекулы, которая затем подвергается расщеплению в нескольких участках с образованием сначала пре-рРНК, а затем зрелых молекул рРНК[31]. Процесс изменения нуклеотидной последовательности РНК после синтеза носит название процессинга или редактирования РНК.
После завершения транскрипции РНК часто подвергается модификациям (см. выше), которые зависят от функции, выполняемой данной молекулой. У эукариот процесс «созревания» РНК, то есть её подготовки к синтезу белка, часто включает сплайсинг: удаление некодирующих белок последовательностей (интронов) с помощью рибонуклеопротеида сплайсосомы. Затем к 5' концу молекулы пре-мРНК эукариот добавляется особый модифицированный нуклеотид (кэп), а к 3' концу несколько аденинов, так называемый «полиА-хвост»[30].
Типы РНК
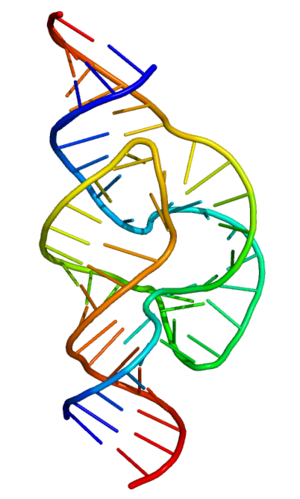
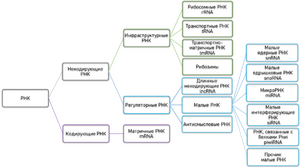
Матричная (информационная) РНК — РНК, которая служит посредником при передаче информации, закодированной в ДНК к рибосомам, молекулярным машинам, синтезирующим белки живого организма. Кодирующая последовательность мРНК определяет последовательность аминокислот полипептидной цепи белка[32]. Однако подавляющее большинство РНК не кодируют белок. Эти некодирующие РНК могут транскрибироваться с отдельных генов (например, рибосомальные РНК) или быть производными интронов[33]. Классические, хорошо изученные типы некодирующих РНК — это транспортные РНК (тРНК) и рРНК, которые участвуют в процессе трансляции[34]. Существуют также классы РНК, ответственные за регуляцию генов, процессинг мРНК и другие роли. Кроме того, есть и молекулы некодирующих РНК, способные катализировать химические реакции, такие, как разрезание и лигирование молекул РНК[35]. По аналогии с белками, способными катализировать химические реакции — энзимами (ферментами), каталитические молекулы РНК называются рибозимами.
Участвующие в трансляции
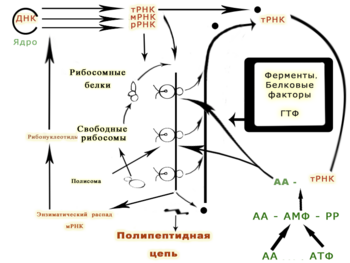
Информация о последовательности аминокислот белка содержится в мРНК. Три последовательных нуклеотида (кодон) соответствуют одной аминокислоте. В эукариотических клетках транскрибированный предшественник мРНК или пре-мРНК процессируется с образованием зрелой мРНК. Процессинг включает удаление некодирующих белок последовательностей (интронов). После этого мРНК экспортируется из ядра в цитоплазму, где к ней присоединяются рибосомы, транслирующие мРНК с помощью соединённых с аминокислотами тРНК.
В безъядерных клетках (бактерии и археи) рибосомы могут присоединяться к мРНК сразу после транскрипции участка ДНК. И у эукариот, и у прокариот цикл жизни мРНК завершается её контролируемым разрушением ферментами рибонуклеазами[32].
Транспортные (тРНК) — малые, состоящие из приблизительно 80 нуклеотидов, молекулы с консервативной третичной структурой. Они переносят специфические аминокислоты в место синтеза пептидной связи в рибосоме. Каждая тРНК содержит участок для присоединения аминокислоты и антикодон для узнавания и присоединения к кодонам мРНК. Антикодон образует водородные связи с кодоном, что помещает тРНК в положение, способствующее образованию пептидной связи между последней аминокислотой образованного пептида и аминокислотой, присоединённой к тРНК[33].
Рибосомальные РНК (рРНК) — каталитическая составляющая рибосом. Эукариотические рибосомы содержат четыре типа молекул рРНК: 18S, 5.8S, 28S и 5S. Три из четырёх типов рРНК синтезируются в ядрышке. В цитоплазме рибосомальные РНК соединяются с рибосомальными белками и формируют нуклеопротеин, называемый рибосомой[32]. Рибосома присоединяется к мРНК и синтезирует белок. рРНК составляет до 80 % РНК, обнаруживаемой в цитоплазме эукариотической клетки[36].
Необычный тип РНК, который действует в качестве тРНК и мРНК (тмРНК) обнаружен во многих бактериях и пластидах. При остановке рибосомы на дефектных мРНК без стоп-кодонов тмРНК присоединяет небольшой пептид, направляющий белок на деградацию[37].
Участвующие в регуляции генов
В живых клетках обнаружено несколько типов РНК, которые могут уменьшать степень выражения гена при комплементарности мРНК или самому гену. Микро-РНК (21-22 нуклеотида в длину) найдены у эукариот и оказывают воздействие через механизм РНК-интерференции. При этом комплекс микро-РНК и ферментов может приводить к метилированию нуклеотидов в ДНК промотора гена, что служит сигналом для уменьшения активности гена. При использовании другого типа регуляции мРНК, комплементарная микро-РНК, деградируется[38]. Однако есть и миРНК, которые увеличивают, а не уменьшают экспрессию генов[39]. Малые интерферирующие РНК (миРНК, 20-25 нуклеотидов) часто образуются в результате расщепления вирусных РНК, но существуют и эндогенные клеточные миРНК[40]. Малые интерферирующие РНК также действуют через РНК-интерференцию по сходным с микро-РНК механизмам[41]. У животных найдены так называемые РНК, взаимодействующие с Piwi (piРНК, 29-30 нуклеотидов), противодействующие в половых клетках увеличению числа копий транспозонов и играющие роль в образовании гамет[42][43]. Кроме того, piРНК могут эпигенетически наследоваться по материнской линии, передавая потомству своё свойство ингибировать экспрессию транспозонов[44].
Антисмысловые РНК широко распространены у бактерий, многие из них подавляют выражение генов, но некоторые активируют экспрессию[45]. Действуют антисмысловые РНК, присоединяясь к мРНК, что приводит к образованию двуцепочечных молекул РНК, которые деградируются ферментами[46]. У эукариот обнаружены высокомолекулярные, мРНК-подобные молекулы РНК, не кодирующие белков. Эти молекулы также регулируют выражение генов[47]. В качестве примера можно привести Xist, присоединяющуюся и инактивирующую одну из двух X-хромосом у самок млекопитающих[48].
Кроме роли отдельных молекул в регуляции генов, регуляторные элементы могут формироваться в 5' и 3' нетранслируемых участках мРНК. Эти элементы могут действовать самостоятельно, предотвращая инициацию трансляции, либо присоединять белки, например, ферритин или малые молекулы, например, биотин[49].
В процессинге РНК
Многие РНК принимают участие в модификации других РНК. Интроны вырезаются из пре-мРНК сплайсосомами, которые, кроме белков, содержат несколько малых ядерных РНК (мяРНК)[34]. Кроме того, интроны могут катализировать собственное вырезание[50]. Синтезированная в результате транскрипции РНК также может быть химически модифицирована. У эукариот химические модификации нуклеотидов РНК, например, их метилирование, выполняется малыми ядерными РНК (мяРНК, 60-300 нуклеотидов). Этот тип РНК локализуется в ядрышке и тельцах Кахаля[33]. После ассоциации мяРНК с ферментами, мяРНК связываются с РНК-мишенью путём образования пар между основаниями двух молекул, а ферменты модифицируют нуклеотиды РНК-мишени. Рибосомальные и транспортные РНК содержат много подобных модификаций, конкретное положение которых часто сохраняется в процессе эволюции. Также могут быть модифицированы мяРНК и сами мяРНК[51][52]. Гидовые РНК осуществляют процесс редактирования РНК в кинетопласте — особом участке митохондрии протистов-кинетопластид (например, трипаносом).
Геномы, состоящие из РНК
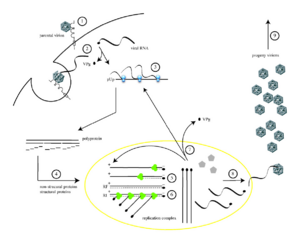
Как и ДНК, РНК может хранить информацию о биологических процессах. РНК может использоваться в качестве генома вирусов и вирусоподобных частиц. РНК-геномы можно разделить на те, которые не имеют промежуточной стадии ДНК и те, которые для размножения копируются в ДНК-копию и обратно в РНК (ретровирусы).
РНК-содержащие вирусы
Многие вирусы, например, вирус гриппа, на всех стадиях содержат геном, состоящий исключительно из РНК. РНК содержится внутри обычно белковой оболочки и реплицируется с помощью закодированных в ней РНК-зависимых РНК-полимераз. Вирусные геномы, состоящие из РНК разделяются на
- содержащие «плюс-цепь РНК», которая используется в качестве и мРНК, и генома;
- «минус-цепь РНК», которая служит только геномом, а в качестве мРНК используется комплементарная ей молекула;
- двухцепочечные РНК.
Вироиды — другая группа патогенов, содержащих РНК-геном и не содержащих белок. Они реплицируются РНК-полимеразами организма хозяина[53].
Ретровирусы и ретротранспозоны
У других вирусов РНК-геном есть в течение только одной из фаз жизненного цикла. Вирионы так называемых ретровирусов содержат молекулы РНК, которые при попадании в клетки хозяина служат матрицей для синтеза ДНК-копии. В свою очередь, с матрицы ДНК считывается РНК-геном. Кроме вирусов обратную транскрипцию применяют и класс мобильных элементов генома — ретротранспозоны[54].
Двухцепочечная РНК
Двухцепочечная РНК (дцРНК) — это РНК с двумя комплементарными цепями, подобная ДНК, обнаруженной во всех клетках, но с заменой тимина урацилом и добавлением одного атома кислорода. Двухцепочечная РНК образует генетический материал некоторых вирусов (вирусов с двухцепочечной РНК). Двухцепочечная РНК, такая как вирусная РНК или миРНК, может запускать РНК-интерференцию у эукариот, а также интерфероновый ответ у позвоночных[55][56][57][58].
Кольцевая РНК
В конце 1970-х было показано, что существует однониточная ковалентно замкнутая, то есть кольцевая форма РНК, экспрессируемая во всем царстве животных и растений (см. circRNA)[59]. Считается, что Кольцевые РНК возникают в результате реакции «обратного сплайсинга», когда сплайсосома соединяет нижележащий донор с расположенным выше акцепторным сайтом сплайсинга. До сих пор функция circRNAs в значительной степени неизвестна.
Гипотеза РНК-мира
Мир РНК — гипотетический этап эволюционной истории жизни на Земле, в котором самореплицирующиеся молекулы РНК размножались до эволюции ДНК и белков.
Концепция мира РНК была предложена в 1962 году Александром Ричем[60], термин был придуман Вальтером Гилбертом в 1986 году[61]. Кроме мира РНК, были предложены и другие химические пути возникновения жизни[62], и жизнь на основе РНК, возможно, не была первой[61][63]. Тем не менее, найдено достаточно доказательств возможности существования мира РНК, поэтому гипотеза получила широкое признание[60][64][65].
Подобно ДНК, РНК может хранить и реплицировать генетическую информацию, в виде ферментов — рибозимов она может катализировать (начинать или ускорять) химические реакции, которые имеют решающее значение для существования жизни[66]. Один из наиболее важных компонентов клетки, рибосомы, состоят, в основном, из РНК. Рибонуклеотидные фрагменты во многих коферментах, таких как ацетил-КоА, NADH, FADH и F420, уже давно считаются сохранившимися остатками ковалентно связанных коферментов в мире РНК[67].
Если РНК-мир существовал, то вероятно, за ним следовала стадия эволюции рибонуклеопротеинов (мир РНП)[68], которым, в свою очередь, наследовали ДНК и более длинные белки. Причина, по которой ДНК стала преобладающей молекулой хранения генетической информации, может быть связана с тем, что она более стабильна и долговечна, чем РНК[68]. Ферменты-белки, возможно, пришли на смену рибозимам на основе РНК в качестве биокатализаторов, поскольку разнообразие мономеров (аминокислот) делает их более универсальными. Поскольку некоторые кофакторы содержат как нуклеотидные, так и аминокислотные характеристики, может быть, аминокислоты, пептиды и, наконец, белки первоначально были сопутствующими факторами рибозимов[67].
См. также
Примечания
- ↑ Dahm R. Friedrich Miescher and the discovery of DNA (англ.) // Developmental Biology : journal. — 2005. — Vol. 278, no. 2. — P. 274—288. — PMID 15680349.
- ↑ Nierhaus KH, Wilson DN. Protein Synthesis and Ribosome Structure. — Wiley-VCH, 2004. — С. 3. — ISBN 3-527-30638-2.
- ↑ Carlier M. L’ADN, cette «simple» molécule. Esprit libre (июнь 2003). Дата обращения: ???. Архивировано 23 августа 2011 года.
- ↑ А. С. Спирин. Биоорганическая химия. — М.: Высшая школа, 1986. — С. 10.
- ↑ Ochoa S. Enzymatic synthesis of ribonucleic acid. Nobel Lecture (1959). Дата обращения: ???. Архивировано 23 августа 2011 года.
- ↑ Георгиев Георгий Павлович — Мегаэнциклопедия Кирилла и Мефодия — статья. Энциклопедия Кирилла и Мефодия. Дата обращения: 8 февраля 2019. Архивировано 17 декабря 2017 года.
- ↑ Научное открытие № 145 Явление синтеза ДРНК (рибонуклеиновой кислоты нового класса) в ядрах клеток высших организмов. ross-nauka.narod.ru. Дата обращения: 8 февраля 2019. Архивировано 28 января 2019 года.
- ↑ Holley RW et al. Structure of a ribonucleic acid (англ.) // Science. — 1965. — Vol. 147, no. 1664. — P. 1462—1465. — doi:10.1126/science.147.3664.1462.
- ↑ Szathmáry E. The origin of the genetic code: amino acids as cofactors in an RNA world // Trends Genet.. — 1999. — Vol. 15, № 6. — P. 223–9. — doi:10.1016/S0168-9525(99)01730-8.
- ↑ Fiers W et al. Complete nucleotide-sequence of bacteriophage MS2-RNA: primary and secondary structure of replicase gene (англ.) // Nature. — 1976. — Vol. 260. — P. 500—507. — PMID 1264203.
- ↑ Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans // Plant Cell. — 1990. — Vol. 2, № 4. — P. 279–89. — PMID 12354959.
- ↑ Ruvkun G. Glimpses of a tiny RNA world (англ.) // Science. — 2001. — Vol. 294, no. 5543. — P. 797—799. — doi:10.1126/science.1066315.
- ↑ Илья Леенсон. Язык химии. Этимология химических названий. — АСТ, 2016. — ISBN 978-5-17-095739-2.
- ↑ Jankowski JAZ, Polak J. M. Clinical gene analysis and manipulation: tools, techniques and troubleshooting (англ.). — Cambridge University Press, 1996. — P. 14. — ISBN 0521478960.
- ↑ Kiss T. Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs (англ.) // The EMBO Journal : journal. — 2001. — Vol. 20. — P. 3617—3622. — doi:10.1093/emboj/20.14.3617.
- ↑ Yu Q., Morrow C. D. Identification of critical elements in the tRNA acceptor stem and TΨC loop necessary for human immunodeficiency virus type 1 infectivity (англ.) // J Virol. : journal. — 2001. — Vol. 75, no. 10. — P. 4902—4906. — doi:10.1128/JVI.75.10.4902-4906.2001.
- ↑ King T. H., Liu B., McCully R. R., Fournier M. J. Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center (англ.) // Molecular Cell : journal. — 2002. — Vol. 11, no. 2. — P. 425—435. — doi:10.1016/S1097-2765(03)00040-6.
- ↑ Barciszewski J., Frederic B., Clark C. RNA biochemistry and biotechnology. — Springer, 1999. — С. 73—87. — ISBN 0792358627.
- ↑ Lee J. C., Gutell R. R. Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs (англ.) // J. Mol. Biol. : journal. — 2004. — Vol. 344, no. 5. — P. 1225—1249. — doi:10.1016/j.jmb.2004.09.072. — PMID 15561141.
- ↑ Salazar M., Fedoroff O. Y., Miller J. M., Ribeiro N. S., Reid B. R. The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution (англ.) // Biochemistry : journal. — 1992. — Vol. 1993, no. 32. — P. 4207—4215. — PMID 7682844.
- ↑ Hermann T., Patel D. J. RNA bulges as architectural and recognition motifs // Structure. — 2000. — Т. 8, № 3. — С. R47—R54. — doi:10.1016/S0969-2126(00)00110-6.
- ↑ Mikkola S., Nurmi K., Yousefi-Salakdeh E., Strömberg R., Lönnberg H. The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group (англ.) // Perkin transactions 2 : journal. — 1999. — P. 1619—1626. — doi:10.1039/a903691a.
- ↑ Mathews D. H., Disney M. D., Childs J. L., Schroeder S. J., Zuker M., Turner D. H. Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — Vol. 101, no. 19. — P. 7287—7292. — doi:10.1073/pnas.0401799101.
- ↑ Redirect (недоступная ссылка). Дата обращения: 5 апреля 2008. Архивировано 20 августа 2007 года.
- ↑ Spriggs K. A., Stoneley M., Bushell M., Willis AE. Re-programming of translation following cell stress allows IRES-mediated translation to predominate (англ.) // Biol Cell. : journal. — 2008. — Vol. 100, no. 1. — P. 27—38.
- ↑ Higgs P. G. RNA secondary structure: physical and computational aspects (англ.) // Quarterly Reviews of Biophysics : journal. — 2000. — Vol. 33. — P. 199—253. — doi:10.1017/S0033583500003620.
- ↑ Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis (англ.) // Science : journal. — 2000. — Vol. 289, no. 5481. — P. 920—930. — doi:10.1126/science.289.5481.920.
- ↑ Jeffrey L Hansen, Alexander M Long, Steve C Schultz. Structure of the RNA-dependent RNA polymerase of poliovirus (англ.) // Structure : journal. — 1997. — Vol. 5, no. 8. — P. 1109—1122. — doi:10.1016/S0969-2126(97)00261-X.
- ↑ Ahlquist P. RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing (англ.) // Science : journal. — 2002. — Vol. 296, no. 5571. — P. 1270—1273. — doi:10.1126/science.1069132.
- ↑ 30,0 30,1 Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. Molecular Biology of the Cell; Fourth Edition (англ.). — New York and London: Garland Science, 2002. — P. 302—303.
- ↑ Wagner R., Theissen G., Zacharias. Regulation of Ribosomal RNA synthesis and Control of ribosome Formation in E.coli (англ.). — 1993. — P. 119—129.
- ↑ 32,0 32,1 32,2 Cooper G. C., Hausman R. E. The Cell: A Molecular Approach. — 3rd edition. — Sinauer, 2004. — С. 261—276. — ISBN 0-87893-214-3.
- ↑ 33,0 33,1 33,2 Wirta W. Mining the transcriptome – methods and applications (англ.). — 2006. — ISBN 91-7178-436-5.
- ↑ 34,0 34,1 Berg J. M., Tymoczko J. L., Stryer L. Biochemistry. — 5th edition. — WH Freeman and Company, 2002. — С. 118—119. — ISBN 0-7167-4684-0.
- ↑ Rossi J. J. Ribozyme diagnostics comes of age // Chemistry & Biology. — 2004. — Т. 11, № 7. — С. 894—895. — doi:10.1016/j.chembiol.2004.07.002.
- ↑ Kampers T., Friedhoff P., Biernat J., Mandelkow E-M, Mandelkow E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments (англ.) // FEBS Letters : journal. — 1996. — Vol. 399. — P. 98—100, 344—49. — PMID 8985176.
- ↑ Gueneau de Novoa P., Williams K. P. The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts (англ.) // Nucleic Acids Res. : journal. — 2004. — Vol. 32, no. Database issue. — P. D104—8. — doi:10.1093/nar/gkh102. — PMID 14681369.
- ↑ Matzke M. A., Matzke AJM. Planting the seeds of a new paradigm (англ.) // PLoS Biology : journal. — 2004. — Vol. 2, no. 5. — P. e133. — doi:10.1371/journal.pbio.0020133. — PMID 15138502.
- ↑ Check E. RNA interference: hitting the on switch (англ.) // Nature. — 2007. — Vol. 448, no. 7156. — P. 855—858. — doi:10.1038/448855a. — PMID 17713502.
- ↑ Vazquez F., Vaucheret H., Rajagopalan R., Lepers C., Gasciolli V., Mallory A. C., Hilbert J., Bartel D. P., Crété P. Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs (англ.) // Molecular Cell : journal. — 2004. — Vol. 16, no. 1. — P. 69—79. — doi:10.1016/j.molcel.2004.09.028. — PMID 15469823.
- ↑ Doran G. RNAi – Is one suffix sufficient? // Journal of RNAi and Gene Silencing. — 2007. — Т. 3, № 1. — С. 217—219. Архивировано 16 июля 2007 года.
- ↑ Horwich M. D., Li C Matranga C., Vagin V., Farley G., Wang P., Zamore P. D. The Drosophila RNA methyltransferase, DmHen1, modifies germline piRNAs and single-stranded siRNAs in RISC (англ.) // Current Biology : journal. — Cell Press, 2007. — Vol. 17. — P. 1265—1272. — doi:10.1016/j.cub.2007.06.030. — PMID 17604629.
- ↑ Girard A., Sachidanandam R., Hannon G. J., Carmell M. A. A germline-specific class of small RNAs binds mammalian Piwi proteins (англ.) // Nature : journal. — 2006. — Vol. 442. — P. 199—202. — doi:10.1038/nature04917. — PMID 16751776.
- ↑ Brennecke J., Malone C. D., Aravin A. A., Sachidanandam R., Stark A., Hannon G. J. An epigenetic role for maternally inherited piRNAs in transposon silencing (англ.) // Science : journal. — 2008. — November (vol. 322, no. 5906). — P. 1387—1392. — doi:10.1126/science.1165171. — PMID 19039138.
- ↑ Wagner E. G., Altuvia S., Romby P. Antisense RNAs in bacteria and their genetic elements (англ.) // Adv Genet. : journal. — 2002. — Vol. 46. — P. 361—398. — PMID 11931231.
- ↑ Gilbert S. F. Developmental Biology. — 7th ed. — Sinauer, 2003. — С. 101—103. — ISBN 0878932585.
- ↑ Hüttenhofer A., Schattner P., Polacek N. Non-coding RNAs: hope or hype? (англ.) // Trends Genet. : journal. — 2005. — Vol. 21, no. 5. — P. 289—297. — doi:10.1016/j.tig.2005.03.007. — PMID 15851066.
- ↑ Heard E., Mongelard F., Arnaud D., Chureau C., Vourc'h C., Avner P. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1999. — Vol. 96, no. 12. — P. 6841—6846. — doi:10.1073/pnas.96.12.6841. — PMID 10359800.
- ↑ Batey R. T. Structures of regulatory elements in mRNAs (англ.) // Curr. Opin. Struct. Biol.. — 2006. — Vol. 16, no. 3. — P. 299—306. — doi:10.1016/j.sbi.2006.05.001. — PMID 16707260.
- ↑ Steitz T. A., Steitz J. A. A general two-metal-ion mechanism for catalytic RNA (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1993. — Vol. 90, no. 14. — P. 6498—6502. — doi:10.1073/pnas.90.14.6498. — PMID 8341661.
- ↑ Covello P. S., Gray M. W. RNA editing in plant mitochondria (англ.) // Nature. — 1989. — Vol. 341. — P. 662—666. — doi:10.1038/341662a0. — PMID 2552326.
- ↑ Omer A. D., Ziesche S., Decatur W. A., Fournier M. J., Dennis P. P. RNA-modifying machines in archaea // Molecular Microbiology. — 2003. — Т. 48, № 3. — С. 617—629. — doi:10.1046/j.1365-2958.2003.03483.x. — PMID 12694609.
- ↑ Daròs J. A., Elena S. F., Flores R. Viroids: an Ariadne's thread into the RNA labyrinth (англ.) // EMBO Rep. : journal. — 2006. — Vol. 7, no. 6. — P. 593—598. — doi:10.1038/sj.embor.7400706. — PMID 16741503.
- ↑ Kalendar R., Vicient C. M., Peleg O., Anamthawat-Jonsson K., Bolshoy A., Schulman A. H. Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes (англ.) // Genetics : journal. — 2004. — Vol. 166, no. 3. — P. D339. — doi:10.1534/genetics.166.3.1437. — PMID 15082561.
- ↑ (2006) «Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing». Nucleic Acids Research 34 (21): 6233–46. doi:10.1093/nar/gkl886. PMID 17090584.
- ↑ (November 2004) «RNA interference: potential therapeutic targets». Applied Microbiology and Biotechnology 65 (6): 649–57. doi:10.1007/s00253-004-1732-1. PMID 15372214.
- ↑ (May 2004) «The interferon system of non-mammalian vertebrates». Developmental and Comparative Immunology 28 (5): 499–508. doi:10.1016/j.dci.2003.09.009. PMID 15062646.
- ↑ (2011) «Silencing or stimulation? siRNA delivery and the immune system». Annual Review of Chemical and Biomolecular Engineering 2: 77–96. doi:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.
- ↑ (July 1979) «Electron microscopic evidence for the circular form of RNA in the cytoplasm of eukaryotic cells» (En). Nature 280 (5720): 339–40. doi:10.1038/280339a0. PMID 460409. .
- ↑ 60,0 60,1 Neveu M., Kim H. J., Benner S. A. The "strong" RNA world hypothesis: fifty years old // Astrobiology. — 2013. — Апрель (т. 13, № 4). — С. 391—403. — doi:10.1089/ast.2012.0868. — . — PMID 23551238.. — «[The RNA world's existence] has broad support within the community today.».
- ↑ 61,0 61,1 Cech T. R. The RNA worlds in context // Cold Spring Harbor Perspectives in Biology. — 2012. — Июль (т. 4, № 7). — С. a006742. — doi:10.1101/cshperspect.a006742. — PMID 21441585.
- ↑ Patel B. H., Percivalle C., Ritson D. J., Duffy C. D., Sutherland J. D. Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism (англ.) // Nature Chemistry : journal. — 2015. — April (vol. 7, no. 4). — P. 301—307. — doi:10.1038/nchem.2202. — . — PMID 25803468.
- ↑ Robertson M. P., Joyce G. F. The origins of the RNA world // Cold Spring Harbor Perspectives in Biology. — 2012. — Май (т. 4, № 5). — С. a003608. — doi:10.1101/cshperspect.a003608. — PMID 20739415.
- ↑ Wade, Nicholas. Making Sense of the Chemistry That Led to Life on Earth, New York Times (4 мая 2015). Архивировано 9 июля 2017 года. Дата обращения 10 мая 2015.
- ↑ Copley S. D., Smith E., Morowitz H. J. The origin of the RNA world: co-evolution of genes and metabolism (англ.) // Bioorganic Chemistry : journal. — 2007. — December (vol. 35, no. 6). — P. 430—443. — doi:10.1016/j.bioorg.2007.08.001. — PMID 17897696.. — «The proposal that life on Earth arose from an RNA World is widely accepted.».
- ↑ Zimmer, Carl. A Tiny Emissary from the Ancient Past, New York Times (25 сентября 2014). Архивировано 27 сентября 2014 года. Дата обращения 26 сентября 2014.
- ↑ 67,0 67,1 Shen, Liang.; Hong-Fang, Ji. Small Cofactors May Assist Protein Emergence from RNA World: Clues from RNA-Protein Complexes (англ.) // PLOS One : journal. — Public Library of Science, 2011. — Vol. 6. — P. e22494. — doi:10.1371/journal.pone.0022494. — PMID 21789260.
- ↑ 68,0 68,1 Garwood, Russell J. Patterns In Palaeontology: The first 3 billion years of evolution (англ.) // Palaeontology Online : journal. — 2012. — Vol. 2, no. 11. — P. 1—14. Архивировано 26 июня 2015 года.
Литература
- Альбертс Б.; Брей Д.; Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3
- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
- Льюин Б. Гены. — М.: Мир, 1987. — 544 с.
- Спирин А. С. Биосинтез белков, мир РНК и происхождение жизни
- Molecular Biology Of The Cell, 4-е издание, 2002 г. — учебник по молекулярной биологии на английском языке