Ортоэфиры
Ортоэфиры — органические соединения, содержащие группу —C(OR)3, где R — органический заместитель[1]. Формально ортоэфиры являются сложными эфирами несуществующих в природе ортокарбоновых кислот R—C(OH)3 и ортоугольной кислоты C(OH)4 — гидратированных форм карбоновых кислот и угольной кислоты[2].
Ортоэфиры именуются как соответствующие производные ортокислот, например, С(ОС2Н5)4 — тетраэтилортокарбонат или тетраэтиловый эфир ортоугольной кислоты; СН3С(ОСН3)3 — триметилортоацетат или триметиловый эфир ортоуксусной кислоты.
По систематической номенклатуре ИЮПАК ортоэфиры именуются как три- или тетраалкоксипроизводные соответствующих углеводородов, например, С(ОС2Н5)4 — тетраэтоксиметан, СН3С(ОСН3)3 — 1,1,1-триметоксиэтан.
Физические свойства
Ортоэфиры являются бесцветными жидкостями с эфирным запахом, хорошо растворимыми в спиртах и диэтиловом эфире, нерастворимы или плохо растворимы в воде. В ИК спектрах ортоэфиров присутствуют характеристические полосы поглощения при 1000—1200 см−1 (связь С—О)[3].
| Соединение | Формула | Молярная масса г/моль |
Температура кипения °C |
Плотность при 20 °C г/моль |
Показатель преломления при 20 °C |
|---|---|---|---|---|---|
| Тетраметилортокарбонат | C(OCH3)4 | 136,15 | 113,5 | 1,0201 | 1,3860 |
| Тетраэтилортокарбонат | C(OC2H5)4 | 192,25 | 160—161 | 0,9186 | 1,3928 |
| Триметилортоформиат | CH(OCH3)3 | 106,12 | 100,4—100,8 | 0,9676 | 1,3793 |
| Триэтилортоформиат | CH(OC2H5)3 | 148,20 | 143 | 0,8909 | 1,3922 |
| Триэтилортоацетат | CH3C(OC2H5)3 | 162,22 | 144-146 | 0,8847 (25 °C) | 1,3980 |
Химические свойства
Ортоэфиры являются высокореакционноспособными соединениями, широко используемыми в органическом синтезе. В отличие от сложных эфиров, большинство ортоэфиров устойчивы к щелочному гидролизу, и, подобно ацеталям и кеталям легко гидролизуются в кислой среде, гидролиз до сложного эфира идет через стабилизированный индуктивным эффектом кислородов карбениевый ион:
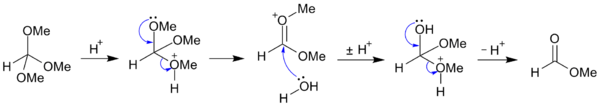
Устойчивость отроэфиров к гидролизу весьма зависит от влияния заместителей, так, трифенилортоформиат примерно в 106 устойчивей к гидролизу по сравнению с триэтилортоформиатом.
Ортоэфиры реагируют со спиртами с образованием простых эфиров:
- ArOH + HC(OEt)3 [math]\displaystyle{ \to }[/math] ArOEt + HCO2Et + EtOH
В случае енолизирующихся кетонов реакция с ортоэфирами в условиях кислотного катализа и повышенной температуры может вести к простому эфиру енола:
- R1COCHR2R3 + CH(OR4)3 [math]\displaystyle{ \to }[/math] R1(R4O)C=CR2R3 + R4OH + HCOOR4
При низких температурах в условиях кислотного катализа или в присутствии кислот Льюиса альдегиды и кетоны взаимодействуют с ортоэфирами с образованием ацеталей и кеталей, кетали енолизирующихся кетонов могут выступать в качестве интермедиатов в предыдущей реакции:
- R1COCHR2R3 + CH(OR4)3 [math]\displaystyle{ \to }[/math] R1(R4O)2C-CHR2R3 + R4OH + HCOOR4
Триэтилортоформиат при нагревании с карбоновыми кислотами дает сложные этиловые эфиры карбоновых кислот, реакция не требует участия катализатора:
- HC(OEt)3 + RCOOH [math]\displaystyle{ \to }[/math] RCOOEt + EtOH + HCOOEt
Тиолы реагируют с ортоэфирами аналогично их кислородным аналогам - спиртам. Так, реакция ортоэфиров с тиолами аналогична переэтерификации - катализируется кислотами и ведет к тиоортоэфирам:
- R1C(OR2)3 + R3SH [math]\displaystyle{ \to }[/math] R1C(SR3)3 + R2OH
Реакция с сероводородом аналогична гидролизу и ведет к эфирам тионкарбоновых кислот:
- PhC(OEt)3 + H2S [math]\displaystyle{ \to }[/math] PhC(=S)OEt + EtOH
Ортоэфиры реагируют с реактивами Гриньяра с образованием ацеталей альдегидов и кетонов:
- R1C(OR2)3 + R3MgHal [math]\displaystyle{ \to }[/math] R1R3C(OR2)2 + R2OMgHal
Взаимодействие ортоформиатов с реактивами Гриньяра является одним из методов синтеза альдегидов (реакция Бодру-Чичибабина):
- HC(OR1)3 + RMgHal [math]\displaystyle{ \to }[/math] RCH(OR1)2 + R1OMgHal
- RCH(OR1)2 + H2O [math]\displaystyle{ \to }[/math] RCHO + 2R1OH
Ортоэфиры также легко конденсируются с соединениями, содержащими активированную электронакцепторными заместителями метиленовую группу, в конденсацию может быть вовлечена как одна молекула соединения с активированной метиленовой группой, что ведет к образованию простых эфиров енолов:
- XYCH2 + R1C(OR2)3 [math]\displaystyle{ \to }[/math] XYCH=C(OR2)R1
- X, Y = COR, CN, NO2,
так и две молекулы соединения с активированной метиленовой группой с образованием «мостикового» фрагмента -C(R)= , образованного ортоэфиром:
- 2 XYCH2 + R1C(OR2)3 [math]\displaystyle{ \to }[/math] XYCH-C(R)=CXY,
Такая реакция используется для синтеза цианиновых красителей.
Получение
Ортоэфиры могут быть синтезированы реакцией Вильямсона - взаимодействием тригалогеналканов с алкоголятами щелочных металлов:
- RCCl3 + 3R1ONa [math]\displaystyle{ \to }[/math] RC(OR1)3 + 3NaCl
Для синтеза ортокарбонатов в реакции Вильямсона используется четыреххлористый углерод или хлорпикрин:
- CCl4 + 4RONa [math]\displaystyle{ \to }[/math] C(OR)4 + 4NaCl
- CCl3NO2 + 4 RONa [math]\displaystyle{ \to }[/math] C(OR)4 + 3NaCl + NaNO2
Синтез Вильямсона ортоэфиров карбоновых кислот в случае наличия в трихлоралкане подвижных атомов водорода в α- или β- положениях может осложняться реакциями элиминирования галогеноводорода, ведущих при наличии водорода в β-положении к алкенам и, в случае наличии водорода в α-положении (галоформы) - карбенов.
В синтезе ортоэфиров по Вильямсону также используются простые α-галогеналкиловые эфиры: ортоформиаты с умеренными выходами могут быть получены взаимодействием 1,1-дихлордиметилового эфира с алкоголятами и фенолятами натрия:
- CH3OCHCl2 + RONa [math]\displaystyle{ \to }[/math] CH3OCH(OR)2 + NaCl
Аналогично протекает взаимодействие хлордифеноксиметана с фенолами и алифатическими спиртами, в присутствии пиридина, дающая с хорошими выходами соответствующие ортоформиаты:
- ClCH(OPh)2 + ROH [math]\displaystyle{ \to }[/math] ROCH(OPh)2
Другой метод синтеза ортоэфиров карбоновых кислот - реакция Пиннера: действие НСl на нитрилы избытке спирта; реакция идет через промежуточное образование гидрохлоридов иминоэфиров, которые могут быть выделены и использованы для получения смешанных ортоэфиров:
- R-CN + HCl [math]\displaystyle{ \to }[/math] R-C(Cl)=NH
- R-C(Cl)=NH + R1OH [math]\displaystyle{ \to }[/math] R-C(OR1)=NH2+ Cl−
- R-C(OR1)=NH2+ Cl− + 2R2OH [math]\displaystyle{ \to }[/math] R-C(OR2)2OR1 + NH4Cl
Ортоэфиры также синтезируются катализируемым кислотами присоединением спиртом к ацеталям кетенов:
- R1R2C=C(OR3)2 + R4OH [math]\displaystyle{ \to }[/math] R1R2CH-C(OR3)2OR4
Взаимодействие сложных эфиров с эпоксидами ведет к циклическим ортоэфирам, содержащим 1,3-диоксолановое кольцо:
Эта реакция используется для синтеза спиро-1,3-диоксоланов:
Нахождение в природе
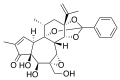
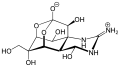
Ортоэфирный фрагмент входит в состав некоторых природных соединений, так, например, волчеягодник обыкновенный Dáphne mezéreum (волчье лыко) содержит дафнетоксин, являющийся циклическим эфиром ортобензойной кислоты; частично гидролизованная ортоэфирная группа входит в состав тетродотоксина некоторых видов ядовитых рыб семейства иглобрюхих (Tetraodontidae).
См. также
Примечания
- ↑ ortho esters // IUPAC Gold Book. Дата обращения: 16 июня 2010. Архивировано 19 мая 2011 года.
- ↑ ortho acids // IUPAC Gold Book. Дата обращения: 16 июня 2010. Архивировано 9 января 2009 года.
- ↑ 3,0 3,1 Рыженков, 1992.
Литература
- Общая органическая химия /Под ред. Д. Бартона и У. Д Уиллиса/. Том 4. Карбоновые кислоты и их производные. Соединения фосфора. «Химия», М. 1982.
- (2020) «Applications of alkyl orthoesters as valuable substrates in organic transformations, focusing on reaction media». RSC Advances 10 (51): 30314–30397. doi:10.1039/D0RA05276K. Проверено 2021-01-25. (обзор)
- Рыженков А. М. Ортоэфиры : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 412—413. — 639 с. — ISBN 5-85270-039-8.