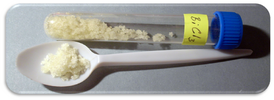
Хлорид висмута(III)
| Хлорид висмута(III) | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
Хлорид висмута(III) |
| Традиционные названия | Хлорид висмута, трихлорид висмута |
| Хим. формула | BiCl3 |
| Рац. формула | BiCl3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 315,34 г/моль |
| Плотность | 4,75[1] |
| Термические свойства | |
| Температура | |
| • плавления | 234[2] |
| • кипения | 440[2] °C |
| Критическая точка | 905 °С, 11,97 МПа[3] |
| Мол. теплоёмк. | 109[3] Дж/(моль·К) |
| Энтальпия | |
| • образования | −378[4] кДж/моль |
| Давление пара | (при 343 °С) 1,33⋅104[3] |
| Классификация | |
| Рег. номер CAS | 7787-60-2 |
| Безопасность | |
| ЛД50 | (крысы, орально) 3324 мг/кг |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д ви́смута(III) (трихлорид висмута, хлористый висмут) — BiCl3, бинарное неорганическое соединение металла висмута с хлором, висмутовая соль хлороводородной кислоты. В нормальных условиях представляет собой белое (бесцветное) или бледно-жёлтое кристаллическое, очень гигроскопичное вещество.
Молекулярная и кристаллическая структура

Хлорид висмута имеет следующий элементный состав: Bi (66,27 %), Cl (33,73 %). Энергия разрыва связи в соединении (Есв.): 275 кДж/моль, длина связи Bi—Cl: 0,248 нм, валентный угол Cl—Bi—Cl составляет 100°[5][6]. Молекула соединения представляет собой тригональную пирамиду, у которой вершина — атом висмута — имеет неподелённую электронную пару.
Кристаллическая структура BiCl3 кубическая.
Физические свойства
Хлорид висмута — белое или бледно-жёлтое, в кристаллическом виде — бесцветное вещество, плавящееся (T пл.= 234 °С) и кипящее без разложения (T кип.= 440 °С). Гигроскопичен, образует кристаллогидрат: BiCl3 • H2O[1].
Водой гидролизуется; растворим в метаноле, этаноле, ацетоне[1][3].
Термодинамические константы:
- стандартная энтальпия образования, ΔHo298: −378 кДж/моль[4];
- стандартная энтропия, So298: 172 Дж/(моль·K)[4];
- стандартная энергия Гиббса, ΔGo298: −313 кДж/моль[4].
- стандартная мольная теплоемкость, Cpo298: 109 Дж/(моль·K)[3];
- энтальпия плавления, ΔHпл: 23,47 кДж/моль[7];
- энтальпия кипения, ΔHкип: 72,59 кДж/моль[7].
Получение
- Прямая реакция элементов при 200 °С:
- 2Bi + 3Cl2 = 2BiCl3.
- Взаимодействие оксида висмута(III) с концентрированной соляной кислотой при нагревании:
- Bi2O3 + 6HCl = 2BiCl3 + 3H2O.
Химические свойства
- Гидролизуется водой:
- BiCl3 + H2O → BiOCl + 2HCl.
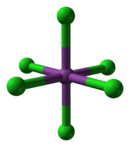
- В солянокислом растворе устойчив, склонен образовывать комплексы — хлорвисмутаты (III):
- BiCl3 + Cl− = [BiCl4]−.
- [BiCl4]− + Cl− = [BiCl5]2−.
- [BiCl5]2− + Cl− = [BiCl6]3−.
 |
 |
 |
- Реагирует с водными растворами щелочей с образованием гидроксида:
- BiCl3 + 3NaOH = Bi(OH)3↓ + 3NaCl.
- При сильном нагревании до 1000°С разлагается до хлорида висмута(I):
- BiCl3 → BiCl + Cl2
Применение
Висмут хлористый используется для получения других солей висмута, в качестве катализатора в органическом синтезе и как компонент пигментов и косметических средств[1].
См. также
Примечания
- ↑ 1,0 1,1 1,2 1,3 Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 109—110. — ISBN 0-07-049439-8.
- ↑ 2,0 2,1 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 85. — ISBN 5-7107-8085-5.
- ↑ 3,0 3,1 3,2 3,3 3,4 [www.xumuk.ru/spravochnik/418.html Серебра хлорид]. Справочник по веществам. XuMuK.ru. Дата обращения: 1 марта 2010.
- ↑ 4,0 4,1 4,2 4,3 Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 452. — ISBN 5-7107-8085-5.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть III. Глава 5. Энергия и длина связи для двухатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 387. — ISBN 5-7107-8085-5.
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть III. Глава 7.1. Геометрическая форма, длина связей и валентные углы в частицах с одним центральным атомом sp-элемента // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 396. — ISBN 5-7107-8085-5.
- ↑ 7,0 7,1 Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Глава 2. Энтальпия и энтропия фазовых переходов // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 532. — ISBN 5-7107-8085-5.
