Жирные кислоты
Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвлённую цепь из чётного числа атомов углерода (от 4 до 24, включая карбоксильный) и могут быть как насыщенными, так и ненасыщенными[1].
В более широком смысле этот термин иногда используется, чтобы охватить все ациклические алифатические карбоновые кислоты, а иногда этим термином охватывают и карбоновые кислоты с различными циклическими радикалами.
Общие сведения
По характеру связи атомов углерода в цепочке жирные кислоты делятся на насыщенные и ненасыщенные. Насыщенные (предельные) содержат только одинарные связи между атомами углерода. Мононенасыщенные (моноеновые) содержат двойную или, что бывает редко, тройную связь. Полиненасыщенные (полиеновые) жирные кислоты имеют две и более двойные или тройные связи. Двойные связи в природных полиненасыщенных жирных кислотах — изолированные (несопряженные). Как правило, связи имеют цис-конфигурацию, что придает таким молекулам дополнительную жесткость.
Жирные кислоты различаются по количеству углеродных атомов в цепи, а также, в случае ненасыщенных кислот, по положению, конфигурации и количеству двойных и тройных связей.
Жирные кислоты можно условно поделить на низшие (до семи атомов углерода), средние (восемь — двенадцать атомов углерода) и высшие (более двенадцати атомов углерода). Карбоновые кислоты могут содержать циклические группы: циклопропановые, циклопропеновые, циклопентиловые, циклопентениловые, циклогексиловые, циклогексениловые, фурановые, иногда их относят тоже к жирным кислотам[2].
Ациклические карбоновые кислоты, начиная с масляной кислоты, считаются жирными. Жирные кислоты, полученные непосредственно из животных жиров, имеют в основном восемь и больше атомов углерода (каприловая кислота). Число атомов углерода в натуральных жирных кислотах в основном чётное, что обусловлено их биосинтезом с участием Ацетил-КоА.
Большая группа жирных кислот (более 400 различных структур, хотя только 10—12 распространены) находятся в растительных маслах семян. Наблюдается высокое процентное содержание редких жирных кислот в семенах определённых семейств растений[3]. В растительных восках также наблюдается содержание различных жирных кислот, в том числе высших: в карнаубском воске из листьев бразильской пальмы карнауба (Copernicia cerifera) и в оурикорийском воске из листьев бразильской пальмы оурикури (Syagrus coronata) содержатся в основном чётные кислоты, имеющие 14—34 атома углерода, канделильский воск из кустарника канделилла (Euphorbia cerifera) из пустыни Чиуауа содержит в основном чётные кислоты, имеющие 10—34 атома углерода, сахарно-тростниковый воск из Saccharum officinarum содержит кислоты, имеющие 12 и 14—36 атомов углерода, пчелиный воск содержит кислоты, имеющие 12, 14 и 16—36 атомов углерода[4].
Под незаменимыми понимаются те жирные кислоты, которые не могут быть синтезированы в организме. Для человека незаменимыми являются кислоты, содержащие по крайней мере одну двойную связь на расстоянии более девяти атомов углерода от карбоксильной группы.
Биохимия
Расщепление
Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При потребности под действием веществ, таких как адреналин, норадреналин, глюкагон и адренокортикотропин запускается процесс липолиза. Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом A (КоА). При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi):
- R-COOH + КоА-SH + АТФ → R-CO-S-КоА + 2Pi + H+ + АМФ
Синтез
В растительном и животном организме жирные кислоты образуются как продукты углеводного и жирового обмена. Синтез жирных кислот осуществляется в противоположность расщеплению в цитозоле, у растений — в пластидах[5]. Реакции, катализируемые синтазами жирных кислот, сходны у всех живых организмов, однако у животных, грибов и некоторых бактерий ферменты работают в составе единого мультиэнзимного комплекса (FAS I), тогда как у остальных бактерий и растений система состоит из отдельных монофункциональных ферментов (FAS II).
Циркуляция
Пищеварение и всасывание
У млекопитающих животных (лат. Mammalia) коротко- и среднецепочечные жирные кислоты всасываются напрямую в кровь через капилляры кишечного тракта и проходят через воротную вену, как и другие питательные вещества. Длинноцепочечные (с количеством атомов углерода от 16 и выше) поглощаются клетками стенок ворсинок (лат. villi intestinales) в тонкой кишке (сегмент кишечника) и заново превращаются в триглицериды. Триглицериды покрываются холестерином и белками с образованием хиломикрона. Внутри ворсинки хиломикрон попадает в лимфатические сосуды, так называемый млечный капилляр, где поглощается большими лимфатическими сосудами. Он транспортируется по лимфатической системе вплоть до места, близкого к сердцу, где кровеносные артерии и вены наибольшие. Грудной проток освобождает хиломикрон в центральный венозный кровоток. Таким образом триглицериды транспортируются в места, где в них нуждаются[6].
Виды существования в организме
Жирные кислоты существуют в различных формах на различных стадиях циркуляции в крови. Они поглощаются в кишечнике, образуя хиломикроны, но в то же время они существуют в виде липопротеинов очень низкой плотности или липопротеинов низкой плотности после превращений в печени. При выделении из адипоцитов жирные кислоты поступают в свободном виде в кровь.
Кислотность
Кислоты с коротким углеводородным хвостом, такие как муравьиная и уксусная кислоты, полностью смешиваются с водой и диссоциируют с образованием достаточно кислых растворов (pKa 3.77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом незначительно отличаются по кислотности. Например, нонановая кислота имеет pKa 4.96. Однако с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате чего эти кислоты мало изменяют pH раствора. Значение величин pKa для данных кислот приобретает значение лишь в реакциях, в которые эти кислоты способны вступить. Кислоты, нерастворимые в воде, могут быть растворены в тёплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледно-розового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
Реакции жирных кислот
Жирные кислоты реагируют так же, как и другие карбоновые кислоты, что подразумевает этерификацию и кислотные реакции. Восстановление жирных кислот приводит к жирным спиртам. Ненасыщенные жирные кислоты также могут вступать в реакции присоединения; наиболее характерно гидрирование, которое используется для превращения растительных жиров в маргарин. В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природных жиров, могут перейти в транс-форму. В реакции Варрентраппа[англ.] ненасыщенные жиры могут быть расщеплены в расплавленной щёлочи. Эта реакция имеет значение для определения структуры ненасыщенных жирных кислот.
Автоокисление и прогоркание
Жирные кислоты при комнатной температуре подвергаются автоокислению и прогорканию. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжёлые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокисление. Чтобы избежать этого, жиры и масла часто обрабатываются хелатирующими агентами, такими как лимонная кислота.
Применение
Натриевые и калиевые соли высших жирных кислот являются эффективными поверхностно-активными веществами и используются в качестве мыл. В пищевой промышленности жирные кислоты зарегистрированы в качестве пищевой добавки E570 как стабилизатор пены, глазирователь и пеногаситель[7].
Разветвлённые жирные кислоты
Разветвлённые карбоновые кислоты липидов обычно не относятся к собственно жирным кислотам, но рассматриваются как их метилированные производные. Метилированные по предпоследнему атому углерода (изо-жирные кислоты) и по третьему от конца цепи (антеизо-жирные кислоты) входят в качестве минорных компонент в состав липидов бактерий и животных.
Монометил-разветвлённые жирные кислоты
Монометил-разветвлённые ненасыщенные жирные кислоты были обнаружены в фосфолипидах морских губок, например, в морской губке Callyspongia fallax обнаружены мононенасыщенные 2-метокси-13-метил-6-тетрадеценовая кислота
- СН3-СН(СН3)-(СН2)5-СН=СН-(СН2)3-С(ОСН3)-СООН,
2-метокси-6-тетрадеценовая кислота
- СН3-(СН2)6-СН=СН-(СН2)3-С(ОСН3)-СООН,
2-метокси-6-пентадеценовая кислота
- СН3-(СН2)7-СН=СН-(СН2)3-С(ОСН3)-СООН
и 2-метокси-13-метил-6-тетрадеценовая кислота
- СН3-СН(СН3)-(СН2)5-СН=СН-(СН2)3-С(ОСН3)-СООН,
а также полиненасыщенная 24-метил-5,9-пентакозадиеновая кислота[8].
- СН3-СН(СН3)-(СН2)13-СН=СН-(СН2)2-СН=СН-(СН2)3-СООН.
В липидах рыбы-солнце (Mola mola) была обнаружена мононенасыщенная 7-метил-7-гексадеценовая кислота
- СН3-(СН2)7-СН=С(СН3)-(СН2)5-СООН,
а 7-метил-6-гексадеценовая кислота
- СН3-(СН2)8-С(СН3)=СН-(СН2)4-СООН
и 7-метил-8-гексадеценовая кислота
- СН3-(СН2)6-СН=СН-СН(СН3)-(СН2)5-СООН
нашлись также в губках[9]. Разветвлённые карбоновые кислоты также входят в состав эфирных масел некоторых растений: так, например, в эфирном масле валерианы содержится монометил-насыщенная изовалериановая кислота (3-метилбутановая кислота) СН3-CH(СН3)-СН2-СООН или .
Мультиметил-разветвлённые жирные кислоты
Мультиметил-разветвлённые кислоты распространены главным образом в бактериях. 13,13-диметил-тетрадекановая кислота
- СН3-С(СН3)2-(СН2)11-СООН
была найдена в микроорганизмах, морских водорослях, растениях и морских беспозвоночных. К этим кислотам относятся фитановая кислота (3,7,11,15-тетраметилгексадекановая кислота)
- СН3-СН(СН3)-(СН2)3-СН(СН3)-(СН2)3- СН(СН3)-(СН2)3- С(СН3)-СН2-СООН
и пристановая кислота (2,6,10,14-тетраметилпентадекановая кислота)
- СН3-СН(СН3)-(СН2)3-СН(СН3)-(СН2)3- СН(СН3)-(СН2)3- С(СН3)-СООН,
конечный продукт распада хлорофилла. Пристановая кислота была обнаружена во многих природных источниках, в губках, моллюсках, молочных жирах, запасных липидах животных и в нефти. Это соединение является продуктом α-окисления фитановой кислоты[10].
Метокси-разветвлённые жирные кислоты
В фосфолипидах губки Amphimedon complanata были обнаружены метокси-разветвлённые насыщенные жирные кислоты: 2-метокси-13-метилтетрадекановая кислота
- СН3-СН(СН3)-(СН2)10-С(ОСН3)-СООН,
2-метокси-14-метилпентадекановая кислота
- СН3-СН(СН3)-(СН2)11-С(ОСН3)-СООН
и 2-метокси-13-метилпентадекановая кислота[11].
- СН3-СН2-СН(СН3)-(СН2)10-С(ОСН3)-СООН.
Миколовые насыщенные жирные кислоты
Особую группу жирных кислот с разветвлённой структурой составляют насыщенные или мононенасыщенные кислоты (более 500 соединений)[12], содержащиеся в оболочках некоторых бактерий. Эти бактерии широко распространены в природе: они встречаются в почве, воде, в организме теплокровных и холоднокровных животных. Среди этих бактерий есть сапрофитные, условно-патогенные (потенциально патогенные) и патогенные виды. Кислоты синтезируемые этими бактериями различных групп и называются миколовыми кислотами. Миколовые кислоты — это разветвлённые 3-гидроксикислоты общего вида R1-СН(ОН)-CH(R2)-СООН, где R1 — может быть гидроксильной, метоксильной, кето или карбоксильной группой, такие кислоты называются дигидроксимиколовые, метоксимиколовые, кетомиколовые, карбоксимиколовые, соответственно, а также эпоксимиколовые, если в кислоте есть эпоксильное кольцо; R2 — алкильная боковая цепь длиной до С24[13]. Примерами простых насыщенных миколовых кислот могут служить 3-гидрокси-2-этил-гексановая кислота
- СН3-(СН2)2-СН(ОН)-СН(С2Н 5)-СООН,
3-гидрокси-2-бутил-октановая кислота,
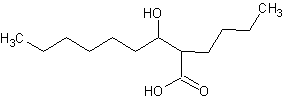
3-гидрокси-2-гексил-декановая кислота
- СН3-(СН2)6-СН(ОН)-СН(С6Н 13)-СООН,
3-гидрокси-2-гептил-ундекановая кислота
- СН3-(СН2)7-СН(ОН)-СН(С7Н 15)-СООН,
3-гидрокси-2-тетрадецил-октадекановая кислота ,
- СН3-(СН2)14-СН(ОН)-СН(С14Н 29)-СООН,
3-гидрокси-2-гексадецил-эйкозановая кислота
- СН3-(СН2)16-СН(ОН)-СН(С16Н 31)-СООН.
В миколовых кислотах бактерий порядка Актиномицеты, например у коринебактерий рода Corynebacterium (возбудителей дифтерии) 32-36 атомов углерода, у нокардий рода Nocardia (возбудителей нокардиоза) — 48-58, а у микобактерий рода Mycobacterium (возбудителей туберкулёзов человека и животных) - 78-95[14]. Миколовые кислоты являются главным компонентом защитной оболочки бактерий (Mycobacterium tuberculosis), которые вызывают туберкулёз человека. Именно присутствие миколовых кислот в оболочке клетки бактерии определяют химическую инертность (в.т.ч. спирто-, щелоче- и кислотоустойчивость), стабильность, механическую прочность, гидрофобность и низкую проницаемость клеточной стенки для лекарств[15].
Циклосодержащие жирные кислоты
Природные жирные кислоты могут содержать циклические элементы. Это могут быть циклопропановые и циклопропеновые кольца, циклопентиловые и циклопентениловые кольца, циклогексиловые и циклогексеновые кольца, а также фурановые кольца. При этом кислоты могут быть как насыщенными, так и ненасыщенными.
Циклопропановые насыщенные жирные кислоты
Некоторые жирные кислоты содержат в составе цепи кольцо циклопропана (такие кислоты находят в липидах бактерий) или циклопропеновое кольцо (в растительных маслах).
Среди насыщенных циклопропановых кислот первой была выделена лактобацилловая, или фитомоновая (11,12-метилен-октадекановая) кислота, получившая своё тривиальное название по грамотрицательным бактериям Lactobacillus arabinosus, в которых нашёл её К. Хофманн в 1950 году.

Позже изомер этой кислоты (9,10-метилен-октадекановую кислоту) нашли в семенах личи китайского (Litchi chinensis) из семейства Сапиндовые.
Другая циклопропановая жирная кислота (9,10-метилен-гексадекановая) присутствует в фосфолипидах митохондрий бычьих сердца и печени, её количество в бычьем сердце составляет около 4 % всех жирных кислот.
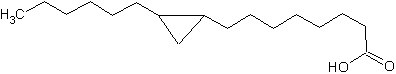
Кроме того, 17-метил-цис-9,10-метилен-октадекановая кислота обнаружена в паразитическом простейшем Herpetomonas megaseliae. Циклопропановые кольца встречаются также в боковых цепях некоторых миколовых кислот.

Циклопропановые ненасыщенные жирные кислоты
Ненасыщенные жирные кислоты с пропановым кольцом встречаются в природе чаще, чем насыщенные, они могут содержать одну, две и более двойных связей. В цианобактерии Lyngbya majuscula найдена маюскуловая (4,5 метилен-11-бром-8,10 тетрадекадиеновая) кислота, 9,10 метилен-5-гексадеценовая и 11,12-метилен-5-октадеценовая кислоты были выделены из клеточной слизи Polysphondylium pallidum из группы слизевиков.

Две кислоты были выделены Т. Немото (Nemoto T.) в 1997 году из австралийской губки рода Amphimedon, эти кислоты названы амфимиковыми: 10,11-метилен-5,9-октакозадиеновая и 10,11-метилен-5,9,21-октакозатриеновая кислоты.
Циклопропеновые жирные кислоты
Циклопропеновые жирные кислоты содержатся в растительных маслах растений, принадлежащих к семействам Стеркулиевые, Гнетовые, Бомбаксовые, Мальвовые , Липовые, Сапиндовые. 9,10-метилен-9-октадеценовая кислота была обнаружена Нанном (Nunn) в 1952 году в масле стеркулии вонючей (Sterculia foetida) из семейства Мальвовые, поэтому получила тривиальное название стеркуловая.

Гомолог этой кислоты был открыт МакФерланом (Mac Farlane) в 1957 году в масле из семян мальвы, поэтому кислоту назвали мальвовой (8,9-метилен-8-гептадеценовой) кислотой.

В процессе очистки масел, содержащих стеркуловую кислоту, последняя легко присоединяет гидроксил, превращаясь в 2-гидрокси-9,10-метилен-9-октадеценовую кислоту.
Полициклобутановые (ладдерановые) жирные кислоты
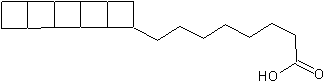
Жирные кислоты с циклобутановыми кольцами были обнаружены в 2002 году в качестве компонентов мембранных липидов анаэробных бактерий из рода Candidatus порядка Planctomycetes, окисляющих аммоний[16].
Эти жирные кислоты могут содержать до пяти линейно-слитых фрагментов циклобутана как у пентациклоанаммоксовой, или 8-[5]-ладдеран-октановой кислоты. Иногда к циклобутановым кольцам добавляются одно или два кольца циклогексана.


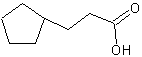
Циклопентиловые жирные кислоты
Простейшими циклопентиловыми кислотами являются 2-циклопентил-уксусная кислота и 3-циклопентил-пропионовая кислота.

Природные тубероновая, или (1R,2S)-2-[(Z)-5-гидрокси-2-пентинил]-3-оксоциклопентан-1-уксусная кислота, содержащаяся в картофеле и получившая своё тривиальное название по его видовому имени (Solánum tuberósum), жасминовая, или жасмоновая (1R,2R)-оксо-2-(2Z)-2-пентен-1-ил-циклопентан-уксусная) кислота, содержащаяся в жасмине,


а также кукурбиновая (3-гидрокси- 2-[2-пентенил]-циклопентан-1-уксусная) кислота, содержащаяся в тыкве (род Cucurbita семейства Тыквенные) и названная её родовым именем, являются ингибиторами роста растений, активно участвующими в их метаболизме.

Среди сложных циклопентиловых кислот можно выделить простановую кислоту, которая является основой простагландинов — липидных физиологически активных веществ.

К рассматриваемой группе кислот относится также многочисленная группа нафтеновых кислот, содержащихся в нефти. Эти кислоты включают представляют собой одноосновные карбоновые кислоты с 5- и 6-членными моно-, би- и трициклами, как, например, 3-(3-этил-циклопентил)-пропановая кислота,

Близко к нафтеновым кислотам стоят своеобразное семейство природных соединений, называемое ARN-кислотами, содержащие от 4 до 8 пентановых циклов, эти соединения создают значительные трудности при добыче и транспортировке нефти.[17].
Циклопентениловые жирные кислоты
Первые циклопентениловые кислоты были открыты Р. Л. Шринером (Shriner R.L.) в 1925 году в масле семян растений рода Гиднокарпус, или Чальмугра (Chaulmoogra) из семейства Ахариевые. Это были ненасыщенные хаульмугровая, или 13-[(1R)-2-циклопентен-1-ил]-тридекановая кислота и гиднокарповая, или 11-(2-циклопентен-1-ил)-ундекановая кислота, содержание которых в масле семян составляет от 9 до 75 %.


В семенах этих растений содержатся и другие жирные кислоты с цепью различной длины и двойной связью в разных положениях, например, горликовая, или 13R-(2-циклопентен-1-ил)-6Z-тридеценовая кислота, которая содержится в семенах упомянутых выше растений в количестве 1,4-25 %.

Биосинтетический предшественник жасмоновой кислоты 12-оксо-фитодиеновая (4-оксо-5R-(2Z)-2-пентил-2-циклопентен-1S-октановая) кислота активно участвует в метаболизме растений.

Кислоты с фурановыми циклами
Первоначально жирные кислоты с фурановыми циклами были найдены среди растительных липидов. Например, в гевеи бразильской была найдена 10,13-эпокси-11,12-диметил-октадека-10,12-диеновая кислота., у дерева эксокарп кипарисообразный (Exocarpus cupressiformisа) с острова Тасмания обнаружили 9,10-эпокси-10,11-диН-нанодека-9,11-диеновую кислоту. Однако позже фурановые жирные кислоты были найдены в тканях рыб и были обнаружены также в человеческой плазме и эритроцитах. По крайней мере, четырнадцать различных фурановых жирных кислот в настоящее время обнаружены в липидах рыб, но наиболее распространенной является 12,15-эпокси-13,14-диметил-эйкоза-12,14-диеновая кислота и её гомологи, меньше распространены монометиловые кислоты, такие как, например, 12,15-эпокси-13-метил-эйкоза-12,14-диеновая кислота[18].
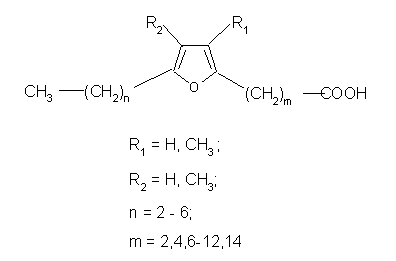
Из человеческой крови выделено несколько короткоцепочечных фурановых двухосновных жирных кислот, которые называются урофурановыми кислотами. Некоторые ученые предполагают, что эти кислоты являются метаболитами кислот с более длинной цепью. Когда нарушается функция почек, в организме накапливается 3-карбокси-4-метил-5-пропил-2-фуранопропановая кислота, которая является уремическим токсином[19].

Основные жирные кислоты
Насыщенные жирные кислоты
Общая формула: CnH2n+1COOH или CH3—(CH2)n—COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | Рациональная полуразвернутая формула | Нахождение | Тпл, °C | pKa |
|---|---|---|---|---|---|---|
| Пропионовая кислота | Пропановая кислота | C2H5COOH | CH3(CH2)COOH | Нефть | −21 | |
| Масляная кислота | Бутановая кислота | C3H7COOH | CH3(CH2)2COOH | Сливочное масло, древесный уксус | −8 |
4,82 |
| Валериановая кислота | Пентановая кислота | C4H9COOH | CH3(CH2)3COOH | Валериана лекарственная | −34,5 | |
| Капроновая кислота | Гексановая кислота | C5H11COOH | CH3(CH2)4COOH | Нефть, кокосовое масло (0,5 %) | −4 | 4,85 |
| Энантовая кислота | Гептановая кислота | C6H13COOH | CH3(CH2)5COOH | Прогорклое сливочное масло | −7,5 | |
| Каприловая кислота | Октановая кислота | C7H15COOH | CH3(CH2)6COOH | Кокосовое масло (5 %), сивушное масло | 17 | 4,89 |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | CH3(CH2)7COOH | Пеларгония (лат. Pelargonium) — род растений из семейства гераниевых | 12,5 | 4.96 |
| Каприновая кислота | Декановая кислота | C9H19COOH | CH3(CH2)8COOH | Кокосовое масло (5 %) | 31 | |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH | CH3(CH2)9COOH | Кокосовое масло (в малом количестве) | 28,6 | |
| Лауриновая кислота | Додекановая кислота | С11Н23СООН | CH3(CH2)10COOH | Кокосовое масло (50 %), пальмовое масло (0,2 %), масло укууба (Virola sebifera) (15—17 %), масло пальмы мурумуру (Astrocaryum murumuru) (47 %), | 43,2 | |
| Тридециловая кислота | Тридекановая кислота | С12Н25СООН | CH3(CH2)11COOH | Цианобактерии (0,24-0,64 %)[20], масло листьев руты (0,07 %), масло карамболы (0,3 %)[21] | 41 | |
| Миристиновая кислота | Тетрадекановая кислота | С13Н27СООН | CH3(CH2)12COOH | Плоды мускатного ореха (Myristica), кокосовое масло (20 %), пальмовое масло (1,1 %), масло укууба (Virola sebifera) (72—73 %), масло пальмы мурумуру (Astrocaryum murumuru) (36,9 %), масло пальмы тукума (Astrocaryum tucuma) (21—26 %) | 53,9 | |
| Пентадециловая кислота | Пентадекановая кислота | С14Н29СООН | CH3(CH2)13COOH | Сливочное масло (1,2 %)[22] бараний жир[23] | 52 | |
| Пальмитиновая кислота | Гексадекановая кислота | С15Н31СООН | CH3(CH2)14COOH | Кокосовое масло (9 %), пальмовое масло (44 %), оливковое масло (7,5—20 %), масло понгамии перистой (3,7—7,9 %), масло укууба (Virola sebifera) (4,4—5 %), масло пальмы мурумуру (Astrocaryum murumuru) (6 %), масло пекуи (48 %), масло кофе (34 %), масло баобаба (25 %), хлопковое масло (23 %) | 62,8 | |
| Маргариновая кислота | Гептадекановая кислота | С16Н33СООН | CH3(CH2)15COOH | Горчичное масло (до 2,1 %), в малых количествах в бараньем жире (1,2 %), сливочном масле (1,2 %), оливковом масле (0,2 %), подсолнечном масле (0,2 %), арахисовом масле (0,2 %) | 61,3 | |
| Стеариновая кислота | Октадекановая кислота | С17Н35СООН | CH3(CH2)16COOH | Кокосовое масло (3 %), пальмовое масло (4,6 %), оливковое масло (0,5—5 %), масло понгамии перистой (2,4-8,9 %), масло пальмы мурумуру (Astrocaryum murumuru) (2,6 %), масло кокум (Garcinia indica) (50—60 %), масло иллипа (Shorea Stenoptera) (42—48 %), масло манго (39 %), масло ши (30—45 %) | 69,4 | |
| Нонадециловая кислота | Нонадекановая кислота | С18Н37СООН | CH3(CH2)17COOH | масло зелёных частей укропа (10 %)[24], красная водоросль (Hypnea musciformis)[25], бактерия (Streptomyces scabiei subsp. chosunensis М0137)[26] | 68,2 | |
| Арахиновая кислота | Эйкозановая кислота | С19Н39СООН | CH3(CH2)18COOH | Арахисовое масло, масло из плодов рамбутана, масло Купуасу (11 %), масло понгамии перистой (2,2—4,7 %), масло авелланского ореха (6,3 %) | 76,2 | |
| Генэйкоциловая кислота | Генэйкозановая кислота | С20Н41СООН | CH3(CH2)19COOH | Масло семян дерева Азадирахта, масло семян дерева мукуна жгучая, грибы опята | 75,2 | |
| Бегеновая кислота | Докозановая кислота | С21Н43СООН | CH3(CH2)20COOH | Масло семян дерева моринга масличная (8 %), масло понгамии перистой (4,7—5,3 %), горчичное масло (2—3 %), масло авелланского ореха (1,9 %) | 80 | |
| Трикоциловая кислота | Трикозановая кислота | С22Н45СООН | CH3(CH2)21COOH | Липиды клеточных мембран высших растений, липофильные компоненты плодовых тел опят и масло семян сладкого перца, рододендрона, пшеницы | 78,7—79,1 | |
| Лигноцериновая кислота | Тетракозановая кислота | С23Н47СООН | CH3(CH2)22COOH | Смола букового дерева, горчичное масло (1—2 %), масло понгамии перистой (1,1—3,5 %) | ||
| Пентакоциловая кислота | Пентакозановая кислота | С24Н49СООН | CH3(CH2)23COOH | Клеточные стенки микроэукариотов | 77—83,5 | |
| Церотиновая кислота | Гексакозановая кислота | С25Н51СООН | CH3(CH2)24COOH | Пчелиный воск (14—15 %)[27], карнаубский воск листьев пальмы Copernicia cerifera, сахарно-тростниковый воск (Saccharum officinarum)[4] | 87,4 | |
| Гептакоциловая кислота | Гептакозановая кислота | С26Н53СООН | CH3(CH2)25COOH | Микроорганизмы группы Mycobacterium | 87,5 | |
| Монтановая кислота | Октакозановая кислота | С27Н55СООН | CH3(CH2)26COOH | Гумито-липоидолитовые и сильно гелифицированные гумитовые угли и торф (монтанский воск), китайский воск из выделений восковой ложнощитовки (Ceroplastes ceriferus) и ложнощитовки пела (Ericerus pela), Сахарно-тростниковый воск (Saccharum officinarum)[4], зверобой продырявленный (Hypericum perforatum)[28]. | 90,9 | |
| Нонакоциловая кислота | Нонакозановая кислота | С28Н57СООН | CH3(CH2)27COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4], зверобой продырявленный (Hypericum perforatum)[28] | ||
| Мелиссовая кислота | Триаконтановая кислота | С29Н59СООН | CH3(CH2)28COOH | Млечный сок одуванчика, пчелиный воск (10-15 %)[29], бобовое растение Desmodium laxiflorum[30], Сахарно-тростниковый воск (Saccharum officinarum)[4], зверобой продырявленный (Hypericum perforatum)[28] | 92—94 | |
| Гентриаконтиловая кислота | Гентриаконтановая кислота | С30Н61СООН | CH3(CH2)29COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4], зверобой продырявленный (Hypericum perforatum)[28] | ||
| Лацериновая кислота | Дотриаконтановая кислота | С31Н63СООН | CH3(CH2)30COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4], зверобой продырявленный (Hypericum perforatum)[28] | ||
| Псилластеариновая кислота | Тритриаконтановая кислота | С32Н65СООН | CH3(CH2)31COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4] | ||
| Геддовая (геддинновая) кислота | Тетратриаконтановая кислота | С33Н67СООН | CH3(CH2)32COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4], гуммиарабик, зверобой продырявленный (Hypericum perforatum)[28] | ||
| Церопластовая кислота | Пентатриаконтановая кислота | С34Н69СООН | CH3(CH2)33COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4] | ||
| Гексатриаконтиловая кислота | Гексатриаконтановая кислота | С35Н71СООН | CH3(CH2)34COOH | Сахарно-тростниковый воск (Saccharum officinarum)[4] |
Ненасыщенные жирные кислоты
Общие сведения о ненасыщенных жирных кислотах
Кислоты, имеющие одну двойную связь, называются мононенасыщенные, две и более двойные связи — полиненасыщенные. Двойные связи могут располагаться по-разному: кислота может иметь конъюгированную (сопряжённую) двойную связь вида —C—C=C—C=C—C—; типичным представителем таких жирных кислот является сорбиновая (трансШаблон:Зпттранс-2,4-гексадиеновая) кислота
- СН3—СН=СН—СН=СН—СООН,
впервые найденная в 1859 году А. В. Гофманом в ягодах рябины обыкновенной (Sorbus aucuparia).
Кислоты могут иметь также несопряжённые двойные связи вида —C—C=C—C—C=C—C—; типичными представителями таких жирных кислот являются линолевая и линоленовая кислоты.
Жирные кислоты могут иметь двойные связи алленового типа —C=C=C— или кумуленового типа —HC=C=C=CH—. Для первого случая примером может служить лаббелиновая кислота (5,6-октадекадиеновая кислота)
- СН3—(СН2)10—СН=С=С—СН—(СН2)3—СООН,
которая была идентифицирована в липидах семян растения Leonotis napetaefolia из семейства яснотковые; для второго — 2,4,6,7,8-декапентаеновая кислота
- СН3—СН=С=С=СН—СН=СН—СН=СН—СООН
и 4-гидрокси-2,4,5,6,8-декапентаеновая кислота
- СН3—СН=СН—СН=С=С=С(ОН)—СН=СН—СООН,
которые были выделены из некоторых растений семейства астровые.
Ненасыщенные жирные кислоты могут содержать также одну или несколько тройных связей. Такие кислоты называют ацетиленовыми, или алкиновыми. К моноалкиновым жирным кислотам относится, например, таурировая (6-октадециновая) кислота
- СН3—(СН2)10—С≡С—(СН2)4—СООН,
которая была впервые выделена из семян Picramnia tariri семейства симарубовые, и 6,9-октадецеиновая кислота
- СН3—(СН2)7—С≡С—СН2—СН=СН—(СН2)4—СООН,
которая была выделена из орехового масла Ongokea klaineana семейства олаксовые. Это полиненасыщенная кислота имеет одну двойную связь в 6-м положении и тройную связь в 9-м положении углеродного скелета.
Некоторые мононенасыщенные жирные кислоты
Общая формула: СН3—(СН2)m—CH=CH—(CH2)n—COOH (m = ω − 2; n = Δ − 2)
| Тривиальное название | Систематическое название (IUPAC) | Брутто-формула | IUPAC формула (с метил.конца) | IUPAC формула (с карб.конца) | Рациональная полуразвёрнутая формула | Тпл, °C |
|---|---|---|---|---|---|---|
| Акриловая кислота | 2-пропеновая кислота | С2Н3COOH | 3:1ω1 | 3:1Δ2 | СН2=СН—СООН | 13 |
| Метакриловая кислота | 2-метил-2-пропеновая кислота | С3Н5СOOH | 4:1ω1 | 4:1Δ2 | СН2=С(СН3)—СООН | 14—15 |
| Кротоновая кислота | 2-бутеновая кислота | С3Н5СOOH | 4:1ω2 | 4:1Δ2 | СН3—СН=СН—СООН | 71,4—71,7 |
| Винилуксусная кислота | 3-бутеновая кислота | С3Н5СOOH | 4:1ω1 | 4:1Δ3 | СН2=СН—СН2—СООН | |
| Лауроолеиновая кислота | цис-9-додеценовая кислота | С11Н21СOOH | 12:1ω3 | 12:1Δ9 | СН3—СН2—СН=СН—(СН2)7—СООН | |
| Миристолеиновая кислота | цис-9-тетрадеценовая кислота | С13Н25СOOH | 14:1ω5 | 14:1Δ9 | СН3—(СН2)3—СН=СН—(СН2)7—СООН | |
| транс-3-гексадеценовая кислота | С15Н29СOOH | 16:1ω13 | 16:1Δ3 | СН3—(СН2)11—СН=СН—(СН2)—СООН | ||
| Пальмитолеиновая кислота | цис-9-гексадеценовая кислота | С15Н29СOOH | 16:1ω7 | 16:1Δ9 | СН3—(СН2)5—СН=СН—(СН2)7—СООН | |
| Рицинолевая кислота | гидрокси-9-цис-октодеценовая кислота | С17Н33СOOH | ||||
| Петроселиновая кислота | цис-6-октадеценовая кислота | С17Н33СOOH | 18:1ω12 | 18:1Δ6 | СН3—(СН2)10—СН=СН—(СН2)4—СООН | |
| Олеиновая кислота | цис-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3—(СН2)7—СН=СН—(СН2)7—СООН | 13—14 |
| Элаидиновая кислота | транс-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3—(СН2)7—СН=СН—(СН2)7—СООН | 44 |
| Цис-вакценовая кислота | цис-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | 18:1Δ11 | СН3—(СН2)5—СН=СН—(СН2)9—СООН | |
| Транс-вакценовая кислота | транс-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | 18:1Δ11 | СН3—(СН2)5—СН=СН—(СН2)9—СООН | |
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | С19Н37СOOH | 20:1ω11 | 19:1Δ9 | СН3—(СН2)9—СН=СН—(СН2)7—СООН | |
| Гондоиновая кислота | цис-11-эйкозеновая кислота | С19Н37СOOH | 20:1ω9 | 20:1Δ11 | СН3—(СН2)7—СН=СН—(СН2)9—СООН | |
| Эруковая кислота | цис-13-докозеновая кислота | С21Н41СOOH | 22:1ω9 | 22:1Δ13 | СН3—(СН2)7—СН=СН—(СН2)11—СООН | 33,8 |
| Нервоновая кислота | цис-15-тетракозеновая кислота | С23Н45СOOH | 24:1ω9 | 24:1Δ15 | СН3—(СН2)7—СН=СН—(СН2)13—СООН |
Некоторые полиненасыщенные жирные кислоты
Общая формула: СН3—(СН2)m—(CH=CH—(CH2)х(СН2)n—COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто-формула | IUPAC формула (с метил. конца) | IUPAC формула (с карб.конца) | Рациональная полуразвёрнутая формула | Тпл, °C |
|---|---|---|---|---|---|---|
| Сорбиновая кислота | трансШаблон:Зпттранс-2,4-гексадиеновая кислота | С5Н7COOH | 6:2ω2 | 6:2Δ2,4 | СН3—СН=СН—СН=СН—СООН | 134 |
| Линолевая кислота | цисШаблон:Зптцис-9,12-октадекадиеновая кислота | С17Н31COOH | 18:2ω6 | 18:2Δ9,12 | СН3(СН2)3—(СН2—СН=СН)2—(СН2)7—СООН | −5 |
| γ-Линоленовая кислота | цисШаблон:ЗптцисШаблон:Зптцис-6,9,12-октадекатриеновая кислота | С17Н29COOH | 18:3ω6 | 18:3Δ6,9,12 | СН3—(СН2)—(СН2—СН=СН)3—(СН2)6—СООН | |
| α-Линоленовая кислота | цисШаблон:ЗптцисШаблон:Зптцис-9,12,15-октадекатриеновая кислота | С17Н29COOH | 18:3ω3 | 18:3Δ9,12,15 | СН3—(СН2—СН=СН)3—(СН2)7—СООН | |
| Арахидоновая кислота | цис-5,8,11,14-эйкозотетраеновая кислота | С19Н31COOH | 20:4ω6 | 20:4Δ5,8,11,14 | СН3—(СН2)4—(СН=СН—СН2)4—(СН2)2—СООН | −49,5 |
| Дигомо-γ-линоленовая кислота | 8,11,14-эйкозатриеновая кислота | С19Н33COOH | 20:3ω6 | 20:3Δ8,11,14 | СН3—(СН2)4—(СН=СН—СН2)3—(СН2)5—СООН | |
| Клупанодоновая кислота | 4,7,10,13,16-докозапентаеновая кислота | С19Н29COOH | 20:5ω4 | 20:5Δ4,7,10,13,16 | СН3—(СН2)2—(СН=СН—СН2)5—(СН2)—СООН | |
| Тимнодоновая кислота | 5,8,11,14,17-эйкозапентаеновая кислота | С19Н29COOH | 20:5ω3 | 20:5Δ5,8,11,14,17 | СН3—(СН2)—(СН=СН—СН2)5—(СН2)2—СООН | |
| Цервоновая кислота | 4,7,10,13,16,19-докозагексаеновая кислота | С21Н31COOH | 22:6ω3 | 22:3Δ4,7,10,13,16,19 | СН3—(СН2)—(СН=СН—СН2)6—(СН2)—СООН | |
| Мидовая кислота | 5,8,11-эйкозатриеновая кислота | С19Н33COOH | 20:3ω9 | 20:3Δ5,8,11 | СН3—(СН2)7—(СН=СН—СН2)3—(СН2)2—СООН |
См. также
Примечания
- ↑ fatty acids // IUPAC Gold Book. Дата обращения: 7 декабря 2011. Архивировано 9 января 2012 года.
- ↑ William W. Christie. Fatty acids: natural alicyclic — structures, occurrence and biochemistry Архивная копия от 1 марта 2014 на Wayback Machine
- ↑ Содержание кислот в различных растительных маслах. Дата обращения: 28 мая 2013. Архивировано 2 января 2014 года.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 Содержание кислот в различных растительных восках (недоступная ссылка). Дата обращения: 3 июня 2013. Архивировано 2 января 2014 года.
- ↑ Buchanan B. B., Gruissem W., Jones R. L. Biochemistry and Molecular Biology of Plants. — 2nd ed.. — Wiley Blackwell, 2015. — ISBN 9780470714225.
- ↑ Обмен липидов. Дата обращения: 25 июня 2009. Архивировано 26 марта 2012 года.
- ↑ Архивированная копия (недоступная ссылка). Дата обращения: 13 мая 2008. Архивировано 21 апреля 2008 года. (недоступная ссылка с 13-05-2017 [2754 дня])
- ↑ Carballeira NM, Pagán M. New methoxylated fatty acids from the Caribbean sponge Callyspongia fallax./ Nat Prod. 2001 May;64(5):620-3. Дата обращения: 3 октября 2017. Архивировано 20 мая 2016 года.
- ↑ William W. Christie. Fatty acids: branched-chain — structures, occurrence and biosynthesis Архивная копия от 2 января 2014 на Wayback Machine
- ↑ Mukherji M et al., Prog Lipid Res 2003, 42, 359—376) Архивная копия от 2 января 2014 на Wayback Machine
- ↑ Carballeira NM, Alicea J. The first naturally occurring alpha-methoxylated branched-chain fatty acids from the phospholipids of Amphimedon complanata. / Lipids. 2001 Jan; 36(1):83-7
- ↑ Mycolic Acids (недоступная ссылка). Дата обращения: 10 июня 2013. Архивировано 13 июля 2012 года.
- ↑ Jean Asselineau,Gilbert Lanéelle. MYCOBACTERIAL LIPIDS: A HISTORICAL PERSPECTIVE /Frontiers in Bioscience 3, e164-174, October 1, 1998. Дата обращения: 10 июня 2013. Архивировано 21 мая 2013 года.
- ↑ Elie Rafidinarivo, Marie-Antoinette Lanéelle, Henri Montrozier, Pedro Valero-Guillén, José Astola, Marina Luquin, Jean-Claude Promé, and Mamadou Daffé1. Trafficking pathways of mycolic acids: structures, origin, mechanism of formation, and storage form of mycobacteric acids. Дата обращения: 7 июня 2013. Архивировано 20 июля 2018 года.
- ↑ Батраков С. Г., Садовская В. Л., Розынов Б. В., Коронелли Т. В., [[Бергельсон, Лев Давидович|Бергельсон Л. Д.]] Липиды микобактерий // Биоорганическая химия — 1978. — т.4. — № 5. — С.667-681.. Дата обращения: 7 июня 2013. Архивировано 2 января 2014 года.
- ↑ Linearly concatenated cyclobutane lipids form a dense bacterial membrane. Дата обращения: 3 октября 2017. Архивировано 19 сентября 2016 года.
- ↑ Ben E. Smith, Paul A. Sutton,C. Anthony Lewis. Analysis of ARN naphthenic acids by high temperature gas chromatography and high performance liquid chromatography. J. Sep. Sci. 2007, 30, 375—380. http://onlinelibrary.wiley.com/doi/10.1002/jssc.200600266/pdf Архивная копия от 19 мая 2014 на Wayback Machine
- ↑ William W. Christie. Fatty acids: natural alicyclic — structures, occurrence and biochemistry Архивировано 21 июля 2011 года.
- ↑ William W. Christie. Fatty acids: hydroxy, epoxy, furanoid, methoxyl, oxo — structures, occurrence and biochemistry Архивная копия от 2 января 2014 на Wayback Machine
- ↑ T. Rezanka; I. Dor; A. Prell; V.M. Dembitsky/ Fatty acid composition of six freshwater wild cyanobacterial species // Folia Microbiol., 2003, 48 (1), S. 71—75.
- ↑ Datenblatt der The Good Scents Company; 10. Juni 2008. Дата обращения: 30 мая 2013. Архивировано 2 января 2013 года.
- ↑ Rolf Jost «Milk and Dairy Products» Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a16_589.pub3
- ↑ HANSEN R. P., SHORLAND F. B., COOKE N. J. The occurrence of n-pentadecanoic acid in hydrogenated mutton fat. (англ.) // The Biochemical journal. — 1954. — Vol. 58, no. 4. — P. 516—517. — PMID 13229996.
- ↑ W.M. Amin, A.A. Sleem: «Chemical And Biological Study Of Aerial Parts Of Dill (Anethum Graveolens L.)», In: Egyptian Journal of Biomedical Sciences, 23. 2007, S. 73—90
- ↑ S. Siddqiui; S.B. Naqvi Shyum; K.Usmanghani; M.Shameel. Antibacterial activity and fatty acid composition of the extract from Hypnea musciformis (Gigartinales, Rhodophyta) // Pak. J. Pharm. Sci., 6. 1993, S. 45—51
- ↑ J.C. Yoo; J.M. Han; S.K. Nam; O.H. Ko; C.H. Choi; K.H. Kee; J.K Sohng; J.S. Jo; C.N. Seong Characterization and cytotoxic activities of nonadecanoic acid produced by Streptomyces scabiei subsp. chosunensis M0137 (KCTC 9927) // Journal of Microbiology 40. 2002, S. 331—334.
- ↑ Bienenwachs. Bayerische Landesanstalt für Weinbau und Gartenbau (PDF; 50 kB) Архивировано 6 апреля 2013 года.
- ↑ 28,0 28,1 28,2 28,3 28,4 28,5 Новые для зверобоя продырявленного (Hypericum perforatum) вещества Архивная копия от 2 января 2014 на Wayback Machine
- ↑ Bayerische Landesanstalt für Weinbau und Gartenbau: Bienenwachs. Архивировано 6 апреля 2013 года. (PDF; 50 kB)
- ↑ Robert Hegnauer: Chemotaxonomie der Pflanzen, 2001, Birkhäuser-Verlag, ISBN 3-7643-6269-3.
Литература
- Жирные кислоты липидов // Большая российская энциклопедия. Том 10. — М., 2008. — С. 95.
- Локтев С. М. Высшие жирные кислоты. М., Наука, 1964
- Болотин И. М., Милосердов П. Н., Суржа Е. И.. Синтетические жирные кислоты и продукты на их основе. М., Химия, 1970
- Фрейдлин Г. Н. Алифатические дикарбоновые кислоты. М., Химия, 1978
- Fatty Acids. Their Chemistry, Properties, Production and Uses. New York: Interscience, 1960, vol. 1-4.