Элвитегравир
| Элвитегравир | |
|---|---|
 | |
 | |
| Химическое соединение | |
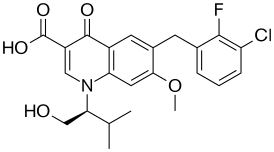
| ИЮПАК | 6-[(3-Chloro-2-fluorophenyl)methyl]-1-[(2S)-1-hydroxy-3-methylbutan-2-yl]-7-methoxy-4-oxoquinoline-3-carboxylic acid |
| CAS | 697761-98-1 |
| PubChem | 5277135 |
| DrugBank | DB09101 |
| Состав | |
| Классификация | |
| АТХ | J05AJ02 |
| Фармакокинетика | |
| Связывание с белками плазмы | 98% |
| Метаболизм | печень, через CYP3A |
| Период полувывед. | 12.9 (8.7–13.7) часов |
| Экскреция | печень 93%, почечный 7% |
| Способы введения | |
| Перорально | |
Элвитегравир (EVG) – ингибитор интегразы, используемый для лечения ВИЧ-инфекции. Был разработан[1] фармацевтической компанией Gilead Sciences, которая в марте 2008 года лицензировала EVG у Japan Tobacco[2][3][4]. 27 августа 2012 года препарат был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для использования у взрослых пациентов, впервые начинающих лечение от ВИЧ в составе комбинации с фиксированной дозой, известной как Stribild[5]. 24 сентября 2014 года FDA одобрило элвитегравир в виде одной таблетки под торговым названием Vitekta[6]. 5 ноября 2015 года FDA одобрило препарат для использования у пациентов, инфицированных ВИЧ-1, как часть второй комбинированной таблетки с фиксированной дозой, известной как Genvoya[7].
Согласно результатам клинического исследования фазы II, пациенты, принимавшие элвитегравир один раз в день, усиленные ритонавиром, имели большее снижение вирусной нагрузки через 24 недели по сравнению с людьми, рандомизированными для получения ингибитора протеазы, усиленного ритонавиром[8].
Медицинское использование
В Соединенных Штатах элвитегравир может быть получен либо в составе комбинированных таблеток Stribild или Genvoya, либо в виде одной таблетки Vitekta[9].
Vitekta одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для использования для лечения ВИЧ-1 инфекции у взрослых, которые ранее получали антиретровирусную терапию. Он должен использоваться в сочетании с ингибитором протеазы, который вводится одновременно с ритонавиром, а также с дополнительными антиретровирусными препаратами[10].
Побочные эффекты
Наиболее частыми побочными эффектами приема элвитегравира являются диарея (у 7% пациентов) и тошнота (у 4%). Другие побочные эффекты, которые наблюдались у более чем 1% людей – это головная боль, усталость, сыпь и рвота[10][11].
Взаимодействия и противопоказания
Элвитегравир метаболизируется через печеночный фермент CYP3A. Вещества, индуцирующие этот фермент, могут снижать концентрацию элвитегравира в организме, потенциально вызывая развитие резистентных штаммов вирусов. Следовательно, одновременное применение сильных индукторов CYP3A противопоказано; примерами являются рифампицин, противосудорожные препараты карбамазепин, фенобарбитал и фенитоин, а также зверобой[11].
Глюкуронизации элвитегравира способствуют ферменты UGT1A1 и UGT1A3, что приводит к повышению уровня в плазме крови при приеме вместе с сильными ингибиторами UGT1A, такими как ритонавир и другие ингибиторы протеазы ВИЧ[11][12]. (Но ритонавир также увеличивает уровень элвитегравира, ингибируя CYP3A).
Кроме того, элвитегравир является индуктором CYP1A2, CYP2C19, CYP2C9, CYP3A и ряда УДФ-ГТ от слабого до среднего; однако клиническая значимость этих результатов неясна[11].
Фармакология
Механизм действия
Элвитегравир подавляет фермент интегразу ВИЧ-1 и ВИЧ-2 в меньшей степени. Вирусу нужен этот фермент, чтобы интегрировать свой генетический код в ДНК хозяина[11].
Фармакокинетика
Препарат принимают внутрь. При приеме вместе с ритонавиром и едой максимальная концентрация в плазме крови достигается через четыре часа. Биодоступность лучше при приеме жирной пищи. В кровотоке 98–99% вещества связывается с белками плазмы. Он метаболизируется в основном за счет окисления CYP3A и, во-вторых, за счет глюкуронизации UGT1A1 и UGT1A3. Около 95% выводится с калом, а остальные – с мочой. Период полувыведения из плазмы при сочетании с ритонавиром составляет от 8,7 до 13,7 часов[11].
Примечания
- ↑ "Phase III Clinical Trial of Gilead's Investigational Elvitegravir Meets 48-Week Primary Objective". gilead.com (March 23, 2011). Дата обращения: 21 мая 2021.
- ↑ "Gilead and Japan Tobacco Sign Licensing Agreement for Novel HIV Integrase Inhibitor". gilead.com (March 22, 2005). Дата обращения: 21 мая 2021.
- ↑ (2007) «Broad Anti-Retroviral Activity and Resistance Profile of a Novel Human Immunodeficiency Virus Integrase Inhibitor, Elvitegravir (JTK-303/GS-9137)». J Virol 82 (2): 764–74. doi:10.1128/JVI.01534-07. PMID 17977962.
- ↑ Stellbrink HJ (2007). «Antiviral drugs in the treatment of AIDS: what is in the pipeline ?». Eur. J. Med. Res. 12 (9): 483–95. PMID 17933730.
- ↑ (2012) «Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus co-formulated efavirenz, emtricitabine, and tenofovir for initial treatment of HIV-1 infection: A randomised, double-blind, phase 3 trial, analysis of results after 48 weeks». The Lancet 379 (9835): 2439–2448. doi:10.1016/S0140-6736(12)60917-9. PMID 22748591.
- ↑ "FDA Approval Bulletin". govdelivery.com (2014). Дата обращения: 21 мая 2021.
- ↑ "FDA approves Genvoya as first TAF-based HIV regimen". healio.com (November 05, 2015). Дата обращения: 21 мая 2021.
- ↑ Derek Thaczuk, Michael Carter. "ICAAC: Best response to elvitegravir seen when used with T-20 and other active agents". aidsmap.com (September 19, 2007). Дата обращения: 21 мая 2021. Архивировано 2010.01.02.
- ↑ "FDA Approved Drug Listing". fda.gov (2017). Дата обращения: 21 мая 2021.
- ↑ 10,0 10,1 "Vitekta Package Insert". dailymed.nlm.nih.gov (2014). Дата обращения: 21 мая 2021.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 Austria-Codex : [нем.] / Haberfeld, H.. — Vienna : Österreichischer Apothekerverlag, 2015.
- ↑ (2005) «In vitro inhibition of UDP glucuronosyltransferases by atazanavir and other HIV protease inhibitors and the relationship of this property to in vivo bilirubin glucuronidation». Drug Metabolism and Disposition 33 (11): 1729–39. doi:10.1124/dmd.105.005447. PMID 16118329.