Сульфат сурьмы
| Сульфат сурьмы | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Сульфат сурьмы |
| Традиционные названия | Сернокислая сурьма |
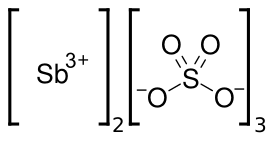
| Хим. формула | Sb2(SO4)3 |
| Физические свойства | |
| Молярная масса | 531,69 г/моль |
| Плотность | 3,6254; 3,63 г/см³ |
| Классификация | |
| Рег. номер CAS | 7446-32-4 |
| PubChem | 24010 |
| SMILES | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат сурьмы — неорганическое соединение, соль металла сурьмы и серной кислоты с формулой Sb2(SO4)3, белые кристаллы, разлагаются водой, образует кристаллогидрат.
Получение
- Медленное растворение металлической сурьмы в концентрированной охлаждённой серной кислоте:
- [math]\displaystyle{ \mathsf{2Sb + 6H_2SO_4 \ \xrightarrow{}\ Sb_2(SO_4)_3\downarrow + 3SO_2\uparrow + 6H_2O } }[/math]
- Вытеснение хлора из хлорида сурьмы концентрированной охлаждённой серной кислотой:
- [math]\displaystyle{ \mathsf{2SbCl_3 + 3H_2SO_4 \ \xrightarrow{}\ Sb_2(SO_4)_3\downarrow + 6HCl } }[/math]
Физические свойства
Сульфат сурьмы образует белые гигроскопичные кристаллы.
Не растворяется в холодной воде, медленно гидролизуется ею.
Из сильнокислых растворов выделяется кристаллогидрат Sb2(SO4)3•H2O.
Химические свойства
- Безводную соль получают медленной сушкой кристаллогидрата:
- [math]\displaystyle{ \mathsf{Sb_2(SO_4)_3\cdot H_2O \ \xrightarrow{20-30^oC, P_2O_5}\ Sb_2(SO_4)_3 + H_2O } }[/math]
- Гидролизуется холодной водой:
- [math]\displaystyle{ \mathsf{Sb_2(SO_4)_3 + H_2O \ \xrightarrow{}\ Sb_2O(SO_4)_2 + H_2SO_4 } }[/math]
- и горячей:
- [math]\displaystyle{ \mathsf{Sb_2(SO_4)_3 + 3H_2O \ \xrightarrow{100^oC}\ Sb_2O_3\downarrow + 3H_2SO_4 } }[/math]
- Реагирует с кислотами:
- [math]\displaystyle{ \mathsf{Sb_2(SO_4)_3 + 8HCl \ \xrightarrow{}\ 2H[SbCl_4] + 3H_2SO_4 } }[/math]
- и щелочами:
- [math]\displaystyle{ \mathsf{Sb_2(SO_4)_3 + 8NaOH \ \xrightarrow{}\ 2Na[Sb(OH)_4] + 3Na_2SO_4 } }[/math]
- При избытке сульфат-ионов растворяется с образованием комплексов типа [math]\displaystyle{ \mathsf{[Sb(SO_4)_2]^-} }[/math] из-за сильных комлексообразующих свойств сурьмы.
Применение
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Третьяков Ю.Д. и др. Неорганическая химия. Химия элементов. — М.: МГУ, 2007. — Т. 2. - 406 с.
