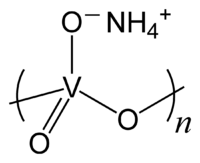
Метаванадат аммония
| Метаванадат аммония | |
|---|---|
 | |
 | |
| Общие | |
| Хим. формула | NH4VO3 |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 116,98 г/моль |
| Плотность | 2,326 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | с разл. 138 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,5215; 1,650 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7803-55-6 |
| PubChem | 19968892 |
| SMILES |
|
| RTECS | YWD875000 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Метаванадат аммония — неорганическое соединение, соль аммиака и метаванадиевой кислоты с формулой NH4VO3, белые или желтоватые кристаллы, малорастворимые в воде.
Получение
- Растворение оксида ванадия(V) в концентрированном растворе аммиака:
- Обменной реакцией между метаванадатом натрия и хлоридом аммония:
Физические свойства
Метаванадат аммония образует белые или желтоватые кристаллы ромбической сингонии, пространственная группа P mab, параметры ячейки a = 0,5827 нм, b = 1,1790 нм, c = 0,4902 нм, Z = 4.
Умеренно растворяется в воде, не растворяется в этаноле и диэтиловом эфире.
Химические свойства
- Разлагается при нагревании на воздухе с образованием оксида ванадия(V):
- Разлагается при нагревании в инертной атмосфере с образованием оксида состава
Это происходит из-за того, что аммиак, выделяющийся в первой реакции, способен частично восстановить пентаоксид ванадия до
- Реагирует с кислотами:
- Реагирует с щелочами:
- Восстанавливается водородом:
- Реагирует с гидросульфатом аммония в кислой среде:
- С гидросульфидом аммония и сероводородом образует комплексный сульфид (тиосоль):
Применение
- Катализатор в органическом синтезе.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
