Фаскаплизин
| Фаскаплизин | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
12H-пиридо[1,2-a:3,4-b']дииндол |
| Хим. формула | C18H11N2O+Cl- |
| Физические свойства | |
| Состояние | кристаллы кроваво-красного или кирпично-красного цвета |
| Молярная масса | 306,7 г/моль |
| Термические свойства | |
| Температура | |
| • разложения | 232-235[1] °C |
| Химические свойства | |
| Растворимость | |
| • в воде | менее 2 мг/мл |
| • в ДМСО | 20 мг/мл |
| Классификация | |
| Рег. номер CAS | 114719-57-2 |
| PubChem | 73293 |
| SMILES | |
| InChI | |
| ChEBI | 93765 |
| ChemSpider | 66033 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фаскаплизин (хлорид фаскаплизина) — природное органическое соединение, бисиндольный алкалоид, родоначальник фаскаплизиновых алкалоидов, впервые выделенный в 1988 году из губки рода Fascaplysinopsis в лаборатории Джона Кларди[англ.]. Изначально фаскаплизином называлась соль с хлорид-анионом, однако в настоящее время название используется как для обозначения катиона, так и соли. Хлорид фаскаплизина образует красные кристаллы, разлагающиеся при температуре выше 232 °С.
Обладает широкой биологической активностью, в том числе проявляет анти-ангиогенезную, противоопухолевую и противомикробную активность, является специфическим ингибитором циклин-зависимой киназы CDK-4 и и интеркалятором ДНК.
Биохимическим предшественником считается триптофан.
Нахождение в природе
В природе встречается в губках рода Fascaplysinopsis, Hyrtios, Thorectandra и оболочниках рода Didemnum[2].
Предполагается, что в морских организмах фаскаплизин синтезируется из двух молекул триптофана[3][4].
Полный синтез
Известно более 10 полных синтезов фаскаплизина[2]. Первый был осуществлён в 1990 году в семь стадий из индола с суммарным выходом в 65 %[5]. Ключевой полупродукт — дииндол — был получен в три стадии, а затем циклизован и окислен до фаскаплизина[2].
Физико-химические свойства
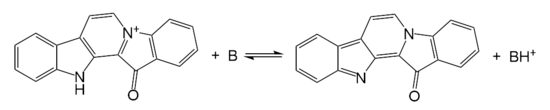
Фаскаплизин образует кристаллы кроваво-красного[1] или кирпично-красного цвета[6] с температурой разложения 232—235 °С[1]. Растворимость в воде менее 2 мг/л[6], в ДМСО — 20 мг/л[1]. Вступает в реакции электрофильного замещения с галогенами и концентрированной серной кислотой по девятому положению. Не образует продукты нитрования при взаимодействии со смесью конценрированных азотной и серной кислот, а также не образует продуктов алкилирования и ацилирования по Фриделю — Крафтсу в классических условиях[7]. Обладает кислотными свойствами, при взаимодействии с основаниями теряет протон образуя незаряженную структуру[8]:
При обработке основаниями в метаноле или водном аммиаке образует структуру, соответствующую алкалоиду ретикулатину[8]:
При обработке метилатом натрия в метаноле образует смесь продуктов, содержащих три метоксильные группы[8]:
При обработке гидрохлоридом гидроксиламина в пиридине, а затем соляной кислотой в метаноле образуется оксим[8]:
При обработке реактивами Гриньяра и алкиллитиевыми реагентами образуются третичные спирты[8]:
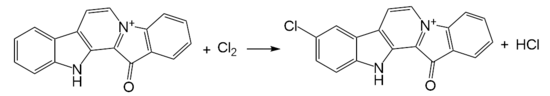
При взаимодействии с хлором в уксусной кислоте при 70 °С образуется 9-хлорфаскаплизин[7]:
При взаимодействии с NBS в уксусной кислоте при 65 °С образуется 9-бромфаскаплизин[7]:
При сульфировании концентрированной серной кислотой образуется цвиттер-ион 9-сульфофаскаплизина[7]:
Биологическая активность
Фаскаплизин является селективным ингибитором циклин-зависимой киназы CDK-4, а также блокирует рост раковых клеток в фале G0/G1 клеточного цикла. При этом активность против других киназ гораздо хуже[2]. Также он проявляет противораковую активность против линии клеток колоректального рака HCT-116, Colo-205 и HCC-2998, клеточных линий меланомы MALME-3M, Mel-5 и M-14, глиобластомы SF-295 и U251, рака яичника OVCAR-3, рака почек RXF-393. Активность не наблюдалась против клеточных линий рака молочной железы HS-578T и BT-549[2].
Фаскаплизин проявляет анти-ангиогенезную активность посредством блокировки факторов роста эндотелия сосудов (VEGF), прямой остановки клеточного цикла и апоптоза на эндотелиальные клетки пупочной вены человека (HUVEC). Кроме того, ингибирует рост клеток линии S180, возможно посредством анти-ангиогенеза, апоптоза или механизмом остановки клеточного цикла[2].
Фаскаплизин проявляет интеркалирующую активность в ДНК сопоставимую с другими типичными интеркаляторами. Предполагается, что связывание происходит за счёт двух водородных связей с Val-96[2].
Показывает противомикробное действие против Staphylococcus aureus, Escherichia coli, Candida albicans, Saccharomyces cerevisae[2].
Природные аналоги фаскаплизина
В природе встречается более десяти различных соединений, которых относят к фаскаплизиновым алкалоидам[2].
| Название | Структурная формула | Природный источник |
|---|---|---|
| Фаскаплизин | 
|
Fascaplysinopsis reticulata, Hyrtios erecta, Thorectandra sp., Didemnum sp. |
| 3-Бромфаскаплизин | 
|
Didemnum sp. |
| 10-Бромфаскаплизин | 
|
Fascaplysinopsis reticulata |
| 3,10-Дибромфаскаплизин | 
|
Fascaplysinopsis reticulata |
| Гомофаскаплизин A | 
|
Fascaplysinopsis reticulata, Hyrtios erecta |
| Гомофаскаплизат A | 
|
Fascaplysinopsis reticulata, Didemnum sp. |
| 3-Бромгомофаскаплизин A | 
|
Didemnum sp. |
| Торектандрамин | 
|
Thorectandra sp. |
| Гомофаскаплизин B | 
|
Fascaplysinopsis reticulata |
| Гомофаскаплизин B-1 | 
|
Didemnum sp. |
| 3-Бромгомофаскаплизин B | 
|
Didemnum sp. |
| 3-Бромгомофаскаплизин B-1 | 
|
Didemnum sp. |
| Гомофаскаплизин C | 
|
Fascaplysinopsis reticulata |
| 3-Бромгомофаскаплизин C | 
|
Didemnum sp. |
Примечания
- ↑ 1,0 1,1 1,2 1,3 Roll et al., 1988.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Bharate et al., 2012.
- ↑ Jimenez et al., 1991.
- ↑ Segraves et al., 2004.
- ↑ Pelcman, Gribble, 1990.
- ↑ 6,0 6,1 Fascaplysin chloride hydrate (англ.). Дата обращения: 9 апреля 2019.
- ↑ 7,0 7,1 7,2 7,3 Fretz et al., 2000.
- ↑ 8,0 8,1 8,2 8,3 8,4 Fretz et al., 2001.
Источники
- Roll D. M., Ireland C. M., Lu H. S. M., Clardy J. Fascaplysin, an unusual antimicrobial pigment from the marine sponge Fascaplysinopsis sp (англ.) // The Journal of Organic Chemistry. — 1988. — Vol. 53, iss. 14. — P. 3276—3278. — ISSN 1520-6904 0022-3263, 1520-6904. — doi:10.1021/jo00249a025.
- Bharate S. B., Manda S., Mupparapu N., Battini N., Vishwakarma R. A. Chemistry and Biology of Fascaplysin, a Potent Marine-Derived CDK-4 Inhibitor (англ.) // Mini-Reviews in Medicinal Chemistry. — 2012. — Vol. 12, iss. 7. — P. 650—664. — ISSN 13895575. — doi:10.2174/138955712800626719.
- Pelcman B., Gribble G. W. Total synthesis of the marine sponge pigment fascaplysin (англ.) // Tetrahedron Letters. — 1990. — Vol. 31, iss. 17. — P. 2381—2384. — doi:10.1016/S0040-4039(00)97367-2.
- Fretz H., Ucci-Stoll K., Hug P., Schoepfer J., Lang M. Investigations on the Reactivity of Fascaplysin, Part I, Aromatic Electrophilic Substitutions Occur at Position 9 (англ.) // Helvetica Chimica Acta. — 2000. — Vol. 83, iss. 11. — P. 3064—3068. — doi:10.1002/1522-2675(20001108)83:11<3064::AID-HLCA3064>3.0.CO;2-P.
- Fretz H., Ucci-Stoll K., Hug P., Schoepfer J., Lang M. Investigations on the Reactivity of Fascaplysin, Part II, General Stability Considerations and Products Formed with Nucleophiles (англ.) // Helvetica Chimica Acta. — 2001. — Vol. 84, iss. 4. — P. 867—873. — doi:10.1002/1522-2675(20010418)84:4<867::AID-HLCA867>3.0.CO;2-A.
- Jimenez C., Quinoa E., Adamczeski M., Hunter L. M., Crews P. Novel sponge-derived amino acids. 12. Tryptophan-derived pigments and accompanying sesterterpenes from Fascaplysinopsis reticulata (англ.) // The Journal of Organic Chemistry. — 1991. — Vol. 56, iss. 10. — P. 3403—3410. — ISSN 1520-6904 0022-3263, 1520-6904. — doi:10.1021/jo00010a041.
- Segraves N. L., Robinson S. J., Garcia D., Said S. A., Fu X. Comparison of Fascaplysin and Related Alkaloids: A Study of Structures, Cytotoxicities, and Sources (англ.) // Journal of Natural Products. — 2004. — Vol. 67, iss. 5. — P. 783—792. — ISSN 1520-6025 0163-3864, 1520-6025. — doi:10.1021/np049935+.