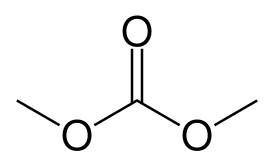
Диметилкарбонат
| Диметилкарбонат[1][2] | |
|---|---|
 | |
| Общие | |
| Сокращения | DMC |
| Хим. формула | C3H6O3 |
| Физические свойства | |
| Молярная масса | 90,0774 г/моль |
| Плотность | 1,070 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 90,3 °C |
| Классификация | |
| Рег. номер CAS | 616-38-6 |
| PubChem | 57651340 |
| Безопасность | |
| Краткие характер. опасности (H) | H225 |
| Меры предостор. (P) | P210, P403+P235 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диметилкарбонат — органическое вещество, сложный эфир угольной кислоты и метанола. В органическом синтезе используется преимущественно как электрофильный реагент для введения метоксикарбонильной группы в соединения.
Получение
Диметилкарбонат получают из фосгена и метанола. Современный способ получения заключается в оксикарбонилировании: монооксид углерода вводят в реакцию с метанолом в присутствии кислорода. Продажный диметилкарбонат можно очистить перегонкой над гидридом кальция[1].
Строение и физические свойства
Диметилкарбонат представляет собой бесцветную жидкость. Он смешивается со спиртами, сложными эфирами, простыми эфирами. Растворимость в воде составляет 13,9 г на 100 г воды при 20 °С. Диметилкарбонат является весьма горючим и может вызывать раздражение глаз, кожи и дыхательных путей[1].
Химические свойства
Диметилкарбонат применяется в органическом синтезе как электрофильный реагент для введения метоксикарбонильной группы. Енолят-ионы, с которыми он реагирует, принято генерировать добавлением к соединениям с подвижным протоном таких оснований, как гидрид натрия (иногда в смеси с гидридом калия), алкоголяты, диизопропиламид лития. Последнее из перечисленных оснований является особенно подходящим, поскольку оно превращает субстрат в енолят-ион нацело и исчезает вероятность протекания реакции енолят-иона с оставшимся субстратом[1].
Так, кетоны можно превратить в β-кетоэфиры, а затем — при повторном метоксикарбонилировании — в малонаты. Также подобной реакции подвергаются арил- и алкилцианиды, нитросоединения и изонитрилы. Метоксикарбонилировать можно и карбоновые кислоты: в этом случае образуются моноэфиры малоновых кислот, а использовать необходимо два эквивалента основания. Диметилкарбонат вступает во взаимодействие с реактивами Гриньяра, образуя сложные эфиры[1].
Также в реакцию метоксикарбонилирования с участием диметилкарбоната вступают анионы, полученные прямым металлированием ароматических соединений. Амины и гидразины вступают в реакцию с диметилкарбонатом, давая соответствующие карбаматы и карбазаты[1].
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 1,3 1,4 1,5 EROS, 2015.
- ↑ Dimethyl carbonate (англ.). Sigma-Aldrich. Дата обращения: 7 января 2020.
Литература
- Diethyl Carbonate (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2015. — doi:10.1002/047084289X.rd180.pub2.