Двухосновные карбоновые кислоты
Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.
Химические свойства
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые — эти свойства обусловлены наличием карбоксильной группы:
- диссоциация в водных растворах:
- первая стадия (Ka1):
- HOOC—X—COOH → HOOC—X—COO− + H+
- Дикарбоновые кислоты — более сильные кислоты по первой стадии диссоциации, чем соответствующие монокарбоновые: во-первых, из-за статистического фактора (две карбоксильные группы в молекуле), во-вторых, из-за взаимного влияния этих групп (если они находятся недалеко или связаны цепью кратных связей);
- вторая стадия (Ka2):
- HOOC—X—COO− → −OOC—X—COO− + H+
- На второй стадии эти кислоты становятся более слабыми, чем монокарбоновые кислоты (исключение — щавелевая кислота). Отделение катиона водорода второй карбоксильной группы происходит труднее, чем первой, так как требуется больше энергии, чтобы отделить H+ от аниона с зарядом −2, чем при отделении от аниона с зарядом −1;
- образование солей: в отличие от монокарбоновых кислот, дикарбоновые способны образовывать кислые соли;
- образование галогенангидридов.
В то же время есть существенные различия, обусловленные наличием второй карбоксильной группы:
- склонность к образованию хелатов;
- образование некоторыми кислотами циклических ангидридов;
- способность образовывать полимеры в реакции с другими полифункциональными соединениями.
Примеры
Некоторые насыщенные дикарбоновые кислоты
Двухосновные предельные карбоновые кислоты алифатического ряда имеют общую формулу HOOC—(CH2)n—COOH, где n = 0, 1, 2, … Систематические названия двухосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса «-диовая» и слова «кислота».
| Тривиальное название | Систематическое название | Химическая структура | pKa1 | pKa2 | Молекулярная масса | Температура плавления (°C) | Растворимость в воде (г. на 100 г.) при 20°C |
|---|---|---|---|---|---|---|---|
| Щавелевая кислота | Этандиовая кислота | HOOC—COOH | 1,27 | 4,23 | 90.02 | 189.5 | 8.6 |
| Малоновая кислота | Пропандиовая кислота | HOOC—CH2—COOH | 2,87 | 5,70 | 104.03 | 135.3 | 73.5 |
| Янтарная кислота | Бутандиовая кислота | HOOC—(CH2)2—COOH | 4,16 | 5,61 | 118.05 | 182.8 | 5.8 |
| Глутаровая кислота | Пентандиовая кислота | HOOC—(CH2)3—COOH | 4,34 | 5,27 | 132.06 | 97.5 | 63.9 |
| Адипиновая кислота | Гександиовая кислота | HOOC—(CH2)4—COOH | 4,26 | 5,30 | 146.8 | 153 | 1.5 |
| Пимелиновая кислота | Гептандиовая кислота | HOOC—(CH2)5—COOH | 4,47 | 5,52 | 160.1 | 105.5 | 5.0 |
| Субериновая кислота | Октандиовая кислота | HOOC—(CH2)6—COOH | 4,51 | 5,40 | 174.11 | 140 | 0.16 |
| Азелаиновая кислота | Нонандиовая кислота | HOOC—(CH2)7—COOH | 4,55 | 5,42 | 188.13 | 106.5 | 0.24 |
| Себациновая кислота | Декандиовая кислота | HOOC—(CH2)8—COOH | 4,62 | 5,59 | 202.4 | 134.5 | 0.1 |
| Не имеет | Ундекандиовая кислота | HOOC—(CH2)9—COOH | 4.65 | 216.27 | 108-110°C | 0.51 | |
| Не имеет | Додекандиовая кислота | HOOC—(CH2)10—COOH | 4.65 | 230.3 | 127–129 °C | 0.004 | |
| Брассиловая кислота | Тридекандиовая кислота | HOOC—(CH2)11—COOH | 4.65 | 244.2 | |||
| Не имеет | Тетрадекандиовая кислота | HOOC—(CH2)12—COOH | 4.65 | 258.2 | 125.8 | ||
| Не имеет | Пентадекандиовая кислота | HOOC—(CH2)13—COOH | 4.65 | 272.3 | 113-114°C | ||
| Тапсиевая кислота | Гексадекандиовая кислота | HOOC—(CH2)14—COOH | 4.65 | 286.4 | 120-123°C | ||
| … | … | … | … | ||||
| Японовая кислота | Генэйкозандиовая кислота | HOOC—(CH2)19—COOH | 356.5 | 117-118°C |
Некоторые ароматические дикарбоновые кислоты
| Тривиальное название | Систематическое название | Химическая структура | pKa1 | pKa2 |
|---|---|---|---|---|
| Фталевая кислота | Бензол-1,2-дикарбоновая кислота |  |
3,54 | 4,46 |
| Изофталевая кислота | Бензол-1,3-дикарбоновая кислота |  |
3,62 | 4,60 |
| Терефталевая кислота | Бензол-1,4-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-1,3-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-1,4-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-1,5-дикарбоноваякислота |  |
||
| Не имеет | Нафталин-1,6-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-1,7-дикарбоновая |  |
||
| Не имеет | Нафталин-1,8-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-2,3-дикарбоновая кислота |  |
||
| Не имеет | Нафталин-2,6-дикарбоновая кислота | 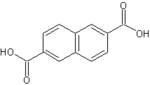 |
||
| Не имеет | Нафталин-2,7-дикарбоновая кислота |  |
||
| Не имеет | 1,1-динафтил-8,8-дикарбоновая кислота | 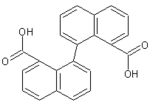 |
||
| Гемипиновая кислота | 3,4-диметоксибензол-1,2-дикарбоновая кислота |  |
Номенклатура
Для карбоновых кислот характерны тривиальные названия, поэтому используют названия природных продуктов, из которых они получены: щавелевая кислота — щавель, янтарная — из янтаря. По номенклатуре ИЮПАК двухосновные кислоты имеют окончания «-диовая» или «-дикарбоновая». Пример: щавелевая — этандиовая кислота, малоновая — пропандиовая или метандикарбоновая.
Применение
Используются для получения полиамидов и полиэфиров — например, таких широкоизвестных полимеров, как капрон и полиэтилентерефталат.