Ацетонитрил
| Ацетонитрил[1][2] | |
|---|---|
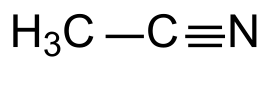  | |
| Общие | |
| Сокращения | ACN |
| Традиционные названия | Нитрил уксусной кислоты |
| Хим. формула | C2H3N |
| Рац. формула | CH3CN |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 41,05 г/моль |
| Плотность | 0,787515 г/см³ |
| Поверхностное натяжение | 26,64·10-3 Н/м |
| Динамическая вязкость | 0,35·10-3 Па·с |
| Энергия ионизации | 1177 кДж/моль |
| Термические свойства | |
| Температура | |
| • плавления | –44 °C |
| • кипения | 81,6 °C |
| • вспышки | 6 °C |
| • самовоспламенения | 524 °C |
| Пределы взрываемости | 3—16 % |
| Критическая точка | |
| • температура | 272,4 °C |
| • давление | 47,7 атм |
| Мол. теплоёмк. | 91,5 Дж/(моль·К) |
| Энтальпия | |
| • образования | -40,6 кДж/моль |
| • плавления | 8,17 кДж/моль |
| • кипения | 29,8 кДж/моль |
| • сублимации | 32,9 кДж/моль |
| Химические свойства | |
| Диэлектрическая проницаемость | 38,8 |
| Оптические свойства | |
| Показатель преломления | 1,3441 |
| Структура | |
| Дипольный момент | 3,924 Д |
| Классификация | |
| Рег. номер CAS | 75-05-8 |
| Безопасность | |
| Предельная концентрация | 10 мг/м³ |
| ЛД50 | 2460 мг/кг (мыши, перорально) |
| Краткие характер. опасности (H) | H225, H302+H312+H332, H319 |
| Меры предостор. (P) | P210, P280, P305+P351+P338 |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетонитри́л (нитрил уксусной кислоты, этаннитрил, метилцианид) — органическое химическое соединение с формулой CH3CN. Представляет собой бесцветную жидкость со слабым эфирным запахом. Широко используется в органической химии в качестве растворителя.
Физические свойства
Ацетонитрил смешивается с водой, этиловым спиртом, диэтиловым эфиром, ацетоном, CCl4 и другими органическими растворителями (кроме углеводородов). Он образует азеотропные смеси с водой (т. кип. 76,5 °C, 83,7 % ацетонитрила), бензолом (73,0 °C, 34 %), CCl4 (65 °C, 17 %), этанолом (72,5 °C, 44 %), этилацетатом (74,8 °C, 23 %), многими алифатическими углеводородами[3].
Ацетонитрил используется для растворения масел, жиров, лаков, эфиров целлюлозы, различных синтетических полимеров и неорганических солей (кроме [math]\ce{ NaCl }[/math] и [math]\ce{ Na2SO4 }[/math])[3].
Получение
В промышленности ацетонитрил получают реакцией уксусной кислоты с небольшим избытком аммиака при 300—400 °C в присутствии катализатора.
- [math]\displaystyle{ \mathsf{CH_3COOH + NH_3 \xrightarrow{t,Al_2O_3} CH_3CONH_2 + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{CH_3CONH_2 \xrightarrow {t} CH_3CN + H_2O} }[/math]
Выход в данном процессе составляет 90—95 %. Ацетонитрил образуется также как побочный продукт в синтезе акрилонитрила при окислительном аммонолизе пропилена[3].
В лабораторных условиях для синтеза ацетонитрила удобно применять реакцию дегидратации ацетамида под действием пентаоксида фосфора[3].
- [math]\displaystyle{ \mathsf{CH_3CONH_2 \xrightarrow {P_2O_5} CH_3CN + H_2O} }[/math]
Лабораторная очистка
Основными примесями в продажном ацетонитриле являются вода, ацетамид, ацетат аммония и аммиак. Осушение ацетонитрила под действием безводных сульфата кальция и хлорида кальция неэффективно. Удалить большую часть воды из ацетонитрила можно встряхиванием с силикагелем или молекулярными ситами. Дальнейшее осушение, а также удаление уксусной кислоты, проводят при добавлении гидрида кальция до окончания выделения водорода. Далее ацетонитрил подвергают фракционной перегонке[4].
Другой способ удаления воды из ацетонитрила заключается в перегонке над небольшим количеством пентаоксида фосфора (0,5—1 % м/о). Избыток P2O5 приводит к образованию оранжевого полимера. Данный метод не подходит в тех случаях, когда ацетонитрил предполагается использовать в реакциях с участием веществ, весьма чувствительных к кислотам. Следы пентаоксида фосфора можно удалить перегонкой над безводным карбонатом калия[4].
Быстрая методика очистки включает осушение над безводным карбонатом калия в течение 24 часов, дальнейшее осушение молекулярными ситами либо борным ангидридом (24 часа) и перегонку[4].
Применение
Ацетонитрил применяется как экстрагент для выделения бутадиена из смеси углеводородов, азеотропный агент для выделения толуола, сырьё для фармацевтической промышленности, растворитель[3].
Применяется также в биохимии как растворитель - важный компонент подвижной фазы для анализа липидного состава биологических образцов (их общелипидных экстрактов) методом высокоэффективной гидрофильной (Hilic) хроматографии.[источник не указан 1715 дней] Кроме этого ацетонитрил широко применяется в обращенно-фазовой хроматографии в качестве подвижной фазы как самостоятельно, так и в смесях с другими растворителями, а также водой, благодаря своей низкой вязкости, слабой реакционной активности. Прозрачность в УФ-диапазоне дает возможность применять ацетонитрил в хроматографических системах с детектированием поглощения в УФ-диапазоне.
Ацетонитрил назывался в числе прекурсоров отравляющего вещества «Новичок»[5], входящего в Список 1 веществ, запрещённых Конвенция о химическом оружия.
Безопасность
Ацетонитрил токсичен, всасывается через кожу[3].
В концентрации 15% или более является прекурсором (Таблица III), оборот которого в Российской Федерации ограничен.
Примечания
- ↑ Dean J. A. Lange's Handbook of Chemistry. — 15th Ed. — McGraw-Hill, Inc, 1999. — ISBN 0-07-016384-7.
- ↑ Sigma-Aldrich. Acetonitrile, anhydrous. Дата обращения: 9 ноября 2013. Архивировано 4 ноября 2015 года.
- ↑ Перейти обратно: 3,0 3,1 3,2 3,3 3,4 3,5 Химическая энциклопедия. В пяти томах. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 231.
- ↑ Перейти обратно: 4,0 4,1 4,2 Armarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — 6th Ed. — Elsevier, 2009. — С. 91—92. — ISBN 978-1-85617-567-8.
- ↑ Gertz, Bill Russia dodges chemical arms ban. Архивировано 23 апреля 2018 года.THE WASHINGTON TIMES. 4 февраля 1997 года
Ссылки
- Sigma-Aldrich. ИК-спектр ацетонитрила. Дата обращения: 10 ноября 2013.
- Sigma-Aldrich. ЯМР-спектр ацетонитрила. Дата обращения: 10 ноября 2013.
