Органические азиды

Азиды — органические соединения, содержащие азидную группу -N=N+=N−, обычно связанную с атомом углерода[1], однако к азидом также относят и элементоорганические соединения (например, триалкилсилил- и триалкилстаннилазиды), и азидпроизводные сульфокислот (сульфонилазиды RSO2N3).
Номенклатура азидов
Названия азидов в номенклатуре IUPAC образуются присоединением суффикса «-азид» к названию радикала, например, C6H5N3 — фенилазид, C6H5CON3 — бензоилазид, (CH3)3SiN3 — триметилсилилазид.
По радикалу, соединённому с азидной группой, различают алифатические и ароматические азиды (алкилазиды и арилазиды), а также азиды карбоновых кислот RCON3 (ацилазиды).
Свойства
Азидная группа линейна, с почти одинаковыми длинами связей азот-азот; так, в метилазиде длина терминальной связи N-N составляет 0,112 нм, «ближней» к углероду связи N-N — 0,124 нм, угол, образуемый связями C-N-N — 120°. В ИК-спектрах арил- и алкилазидов присутствуют характеристические полосы при 2135—2090 см−1 (асимметричные валентные колебания) и 1300—1270 см−1 (симметричные валентные колебания).
Азидная группа в ацил- и сульфонилазидах сопряжена с карбонильной либо сульфонильной группой, в результате чего степень двоесвязности связи связи N-N2 понижается, что ведёт к меньшей, по сравнению с алкил- и арилазидами, стабильности этих соединений и большей реакционной способности в процессах, ведущих к отщеплению от них молекулы азота.
Реакционная способность
При нагревании либо под действием ультрафиолета азиды разлагаются с отщеплением азота и образованием нитренов:
- [math]\displaystyle{ \mathsf{RN_3 \rightarrow RN: + N_2} }[/math]
Нитрены являются высокореакционноспособными интермедиатами в различных реакциях внедрения: так, например, разложение азидов в присутствии алкенов ведёт к образованию N-замещённых азиридинов.
Термическое разложение в инертном растворителе α-азидокетонов, легкодоступных через взаимодействие α-галогенкетонов с азидом натрия, используется как метод синтеза α-оксоиминов; предполагается, что эта реакция идёт через образование нитренового имтермедиата[2]:
- [math]\displaystyle{ \mathsf{RCOCH_2N_3 \rightarrow RCOCH\text{=}NH + N_2} }[/math]
Ацилазиды при нагревании отщепляют азот и перегруппировываются в изоцианаты (перегруппировка Курциуса):
При проведении перегруппировки Курциуса в кислой среде в присутствии воды образующиеся in situ изоцианаты гидролизуются, отщепляя углекислый газ и образуя амины:
- [math]\displaystyle{ \mathsf{RNCO + H_2O \rightarrow RNH_2 + CO_2} }[/math]
эта реакция с промежуточным образованием ацилазидов используется для синтеза аминов из карбоновых кислот.
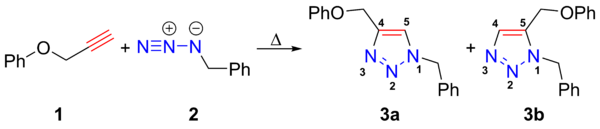
Азиды вступают в реакции 1,3-диполярного циклоприсоединения с ненасыщенными соединениями — диполярофилами, так, присоединение азидов к алкинам ведёт к 1,2,3-триазолам (реакция Хьюсгена):
аналогично реагируют с азидами и нитрилы, образуя тетразолы. С диполярофильными алкенами азиды образуют Δ2−1,2,3-триазолины.
Реактивы Гриньяра присоединяются к арил- и алкилазидам с образованием триазенов (диазоаминосоединений):
- [math]\displaystyle{ \mathsf{RN_3 + R'MgHal \rightarrow R\text{-}N\text{=}N\text{-}N(R')MgHal} }[/math]
- [math]\displaystyle{ \mathsf{R\text{-}N\text{=}N\text{-}N(R')MgHal + H_2O \rightarrow R\text{-}N\text{=}N\text{-}NHR' + Mg(OH)Hal} }[/math]
Взаимодействие азидов с фосфинами или фосфитами (Реакция Штаудингера)проходит с отщепление азота и ведет к образованию фосфазенов [3]:
- R3P + R'N3 [math]\displaystyle{ \to }[/math] R3P=NR' + N2
Синтез
Алкилазиды
Классическим методом синтеза алкилазидов является алкилирование азид-иона алкилгалогенидами, алкилсульфатами и алкилсульфонатами:
- [math]\displaystyle{ \mathsf{RX + N_3^- \rightarrow RN_3 + X^-, \ X = Hal, \ R'SO_2O} }[/math]
Реакция идёт по механизму нуклеофильного замещения SN2 с первичными и вторичнымии может проводиться как в апротонных растворителях, так и в условиях межфазного катализа. В случае третичных алкилгалогенидов реакция затруднена, в этом случае в качестве активатора могут использоваться кислоты Льюиса (ZnCl2).
Азид-ион обладает свойствами псевдогалогенида, поэтому азотистоводородная кислота и галогеназиды присоединяются к непредельным соединениям, подобно галогеноводородам и галогенам, такое присоединение используется для синтеза алкилазидов и α-галогеналкилазидов:
- [math]\displaystyle{ \mathsf{R\text{-}CH\text{=}CH\text{-}COR + HN_3 \rightarrow R\text{-}CH(N_3)\text{-}CH_2\text{-}R'} }[/math]
- [math]\displaystyle{ \mathsf{R\text{-}CH\text{=}CH\text{-}COR' + HalN_3 \rightarrow R\text{-}CH(N_3)\text{-}CHHal\text{-}R'} }[/math]
Присоединение азотистоводородной кислоты к активированным сопряжёнными электронакцепторными заместителями алкенам (α,β-непредельные кетоны и производные α,β-непредельных карбоновых кислот и т. п.) используется как препаративный метод синтеза замещённых алкилазидов, в случае неактивированных алкенов скорость реакции слишком низка.
Арилазиды
Ввиду низкой подвижности галогена в арилгалогенидах синтез арилазидов замещением галогена азид-ионом возможен только в случае активированных арилгалогенидов, общими методами синтеза арилазидов являются реакции образования связи азот-азот при взаимодействии соответствующих азотсодержащих ароматических Ar-N-N с неорганическими реагентами: нитрозирование арилгидразинов:
- [math]\displaystyle{ \mathsf{Ar\text{-}NH\text{-}NH_2 + HNO_2 \rightarrow Ar\text{-}N\text{=}N\text{=}N + 2H_2O} }[/math]
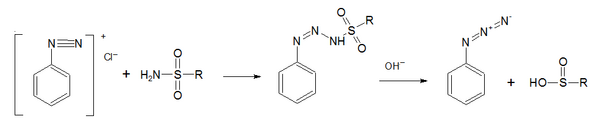
и взаимодействие солей диазония с сульфамидами, протекающее под действием щелочей (реакция Датта-Уормолла)[4]:
Ацилазиды
Ацилазиды могут быть синтезированы как замещением азид-ионом галогена в ацилгалогенидах:
- [math]\displaystyle{ \mathsf{RCOHal + N_3^- \rightarrow RC(O)N_3 + Hal^-} }[/math]
так и нитрозированием гидразидов карбоновых кислот:
- [math]\displaystyle{ \mathsf{RCONHNH_2 + HNO_2 \rightarrow RC(O)N_3 + 2H_2O} }[/math]
Токсичность
Данных о токсичности азидов мало, предполагается, что некоторые из них могут быть ядовитыми.
См.также
Примечания
- ↑ azides // IUPAC Gold Book. Дата обращения: 1 июля 2011. Архивировано 20 октября 2012 года.
- ↑ Boyer, J. H.; Straw, D. Azidocarbonyl Compounds. II. The Pyrolysis of α-Azidocarbonyl Compounds1a (англ.) // Journal of the American Chemical Society[англ.] : journal. — 1953. — 1 April (vol. 75, no. 7). — P. 1642—1644. — ISSN 0002-7863. — doi:10.1021/ja01103a036.
- ↑ Gololobov Yu. G., Zhmurova I. N., Kasukhin L. F. Sixty years of staudinger reaction (англ.) // Tetrahedron. — 1981. — Vol. 37, iss. 3. — P. 437–472. — doi:10.1016/S0040-4020(01)92417-2.
- ↑ P. K. Dutt, H. R. N. Whitehead, and A. Wormall, J. Chem. Soc. 119, 2088 (1921)