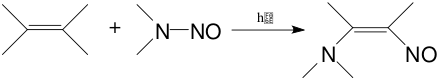Нитрозирование
Нитрозирование — реакция введения нитрозогруппы -NO в молекулы органических соединений.
Реакция нитрозирования может идти по электрофильному или радикальному механизмам, и в таком случае активными частицами выступают соответственно катион нитрозония NO+ и радикал NO•. Реакция нитрозирования протекает по атомам углерода, азота либо кислорода как при замещении нитрозогруппой атома водорода (прямое нитрозирование) или других функциональных групп органического вещества, так и по механизму присоединения нитрозогруппы по кратной связи.
Радикальное нитрозирование
Агентами радикального нитрозирования служат оксиды азота NO, N2O3, N2O4, нитрозилхлорид NOCl, алкилнитриты, иногда N-нитрозамины.
Реакцию нитрозирования в данном случае ведут при УФ-облучении, при повышенной температуре либо в присутствии радикальных инициаторов. Реакция идёт как атака по связи C-H, C-Hal, а также как присоединение оксидов азота и нитрозилхлорида по кратным C=C связям. К данному типу реакций также можно отнести пиролиз алкил- и ацилнитритов, который идёт по механизму внутримолекулярного нитрозирования (реакция Бартона).
Применяется также окислительное нитрозирование аренов гидроксиламином в присутствии окислителей и солей тяжёлых металлов. При этом образуются о-нитрозофенолы (реакция Баудиша):
Электрофильное нитрозирование
Агентами электрофильного нитрозирования являются азотистая кислота, нитрозилсерная кислота, нитрозилхлорид и другие нитрозилгалогениды, оксиды азота NO, N2O3, N2O4, алкил- и ацилнитриты, соли нитрозония, 3-нитро-N-нитрозокарбазол.
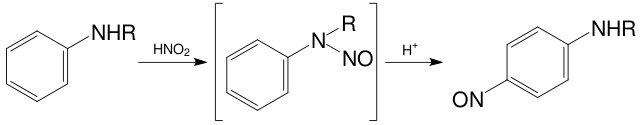
В большинстве случаев электрофильное нитрозирование идёт как атака на sp3-атом углерода с подвижным атомом водорода (например, CH(NO2); на атом азота в первичных и вторичных аминах, амидах, гидразинах, гетероциклических соединениях; на атом кислорода в спиртах, фенолах, карбоновых кислотах. В случае электрофильного нитрозирования ароматических аминов направление нитрозирования зависит от степени замещения аминогруппы: третичные амины нитрозируются в п- и о-положения, а вторичные — в п-положение. При этом сначала нитрозируется атом азота, а затем происходит перегруппировка нитрозогруппы под действием кислот(перегруппировка Фишера-Хеппа):
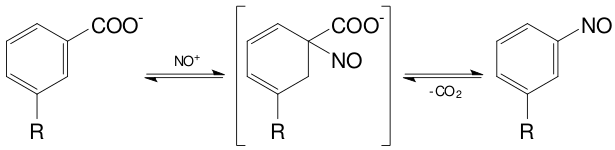
В ряде случаев протекает заместительное нитрозирование: чаще всего наблюдается замещение карбоксильной группы в ароматических карбоновых кислотах:
В случае алифатических кислот и их солей предложен механизм нитрозирования с промежуточным O-нитрозированием:
- [math]\displaystyle{ \mathsf{CF_3C(O)OAg \xrightarrow[]{NOCl} [CF_3C(O)O\text{-}NO] \xrightarrow[-CO_2]{} CF_3NO} }[/math]
- [math]\displaystyle{ \mathsf{2R_2CHC(O)OOH \xrightarrow[-2HCl]{NOCl} 2[R_2CHC(O)ONO] \xrightarrow[-CO_2, \ O_2]{} 2R_2CHNO} }[/math]
Нитрозилгалогениды, N2O4, нитрозилсерная и азотистая кислоты способны присоединяться к кратной C=C связи, что с успехом используется для синтеза замещённых C-нитропроизводных:
- [math]\displaystyle{ \mathsf{CR_2\text{=}CR_2 + NOCl \rightarrow CR_2(NO)\text{-}CR_2Cl} }[/math]
Диены в этих условиях могут присоединять в 1,4-положения:
- [math]\displaystyle{ \mathsf{CH_2\text{=}CH\text{-}CH\text{=}CH_2 + ONOSO_3H \xrightarrow[]{} CH_2(NO)\text{-}CH\text{=}CH\text{-}CH_2OSO_3H + D} }[/math]
Оксимы способны нитрозироваться по связи C=N:
- [math]\displaystyle{ \mathsf{CR_2\text{=}NOH \xrightarrow[]{NOCl} [CR_2Cl\text{-}N(OH)NO] \xrightarrow[]{-HNO} CR_2Cl\text{-}NO} }[/math]
Нитрозирование отдельных классов соединений
- Нитрозирование спиртов
Спирты при нитрозировании образуют нитриты:
- [math]\displaystyle{ \mathsf{HNO_2 + H_2SO_4 \rightarrow [H_2NO_2]^+HSO_4^- \rightleftarrows H_2O + NO^+HSO_4^-} }[/math]
- [math]\displaystyle{ \mathsf{ROH + NO^+HSO_4^- \xrightarrow[^oC]{H_2SO_4} [R\text{-}O(H)\text{-}N\text{=}O]^+HSO_4^- \rightleftarrows R\text{-}ONO + H_2SO_4} }[/math]
- Нитроалканы
Нитроалканы, у которых активирована C-H связь, нитрозируются до нитрозонитроалканов:
- [math]\displaystyle{ \mathsf{R_2CHNO_2 \xrightarrow[]{HNO_2} R_2C(NO)NO_2} }[/math]
- Алифатические и ароматические амины
Первичные амины в реакции нитрозирования через промежуточный катион диазония превращаются в спирты (реакция диазотирования):
- [math]\displaystyle{ \mathsf{RNH_2 + [NO]^+X^- \xrightarrow[]{} [RNH_2\text{-}NO]^+X^- \xrightarrow[-H_2O]{} [R\text{-}N^+\text{=}N]X^- \xrightarrow[]{+H_2O} ROH + N_2 + HX} }[/math]
Вторичные амины в этих условиях образуют N-нитрозоамины:
- [math]\displaystyle{ \mathsf{R_2NH + NOCl \xrightarrow[]{} [R_2N^+H\text{-}NO]Cl^- \rightleftarrows R_2N\text{-}NO + HCl} }[/math]
Третичные амины образуют продукты присоединения:
- [math]\displaystyle{ \mathsf{R_3N + NOCl \rightleftarrows [R_3N\text{-}NO]Cl} }[/math]
- Гидразины
При нитрозировании гидразинов образуются азиды:
- [math]\displaystyle{ \mathsf{RNHNH_2 \xrightarrow[]{HNO_2, \ H^+X^-} RN_3} }[/math]
Применение реакций нитрозирования
Реакции нитрозирования имеют широкое применение в препаративных синтезах, для получения красителей, лекарственных средств, мономеров в производстве каучуков.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.