Фосфазены
Фосфазены — соединения, содержащие двойную связь фосфор-азот. К фосфазенам относят соединения как пятивалентного фосфора общей формулы R3P=NR, так и производные трехвалентного фосфора RP=NR. Большинство известных фосфазенов — производные пятивалентного фосфора. Фосфазеновый фрагмент также является структурной единицей соединений (R2P=N-)n как циклического (циклофосфазены) и каркасного строения, так и полимеров — полифосфазенов. [1]
Структура и свойства
Фосфазены - бесцветные жидкости либо кристаллические вещества, растворимые в органических растворителях.
Атом фосфора фосфазенов имеет тетраэдрическую конфигурацию и находится в состоянии sp3-гибридизации, атом азота - sp2-гибридизован.
Степень двоесвязности P=N увеличивается с ростом электроотрицательности у атома азота, в случае циклофосфазенов и полифосфазенов (-R2P=N-)n может наблюдаться сопряжение, ведущее к выравниванию длин формально двойных и одинарных связей P-N.
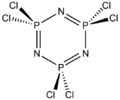
В фосфазенах длина двойной связи P=N существенно ниже, чем длина изолированной простой связи P-N: так, например, в гексахлорциклотрифосфазене длины связей P-N одинаковы и составляют 1.58 ангстрем[2], в то время как в амидофосфате (H3N-PO3)– длина связи P-N - 1.77 ангстрем[3].
В ИК-спектрах фосфазенов присутствует характеристическая полоса связи P=N при 1150-1370 см-1, в спектрах ЯМР химические сдвиги сигналов ядер 31P составляют от -50 до +140 м.д..
Фосфазеновые супероснования
Аминофосфазены — фосфазены, содержащие при атоме фосфора в качестве заместителей аминогруппы, являются сильными основаниями, протонирующимися по атому азота P=N - фрагмента c образованием резонансно стабилизированной структуры.
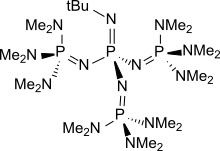
Так, константы диссоциации сопряженных кислот pKBH+ аминофосфазенов в ацетонитриле составляют ~26.5-28.5[4] и повышаются с ростом объема заместителей (у BEMP[5] pKBH+ = 27.6). Основность полиаминофосфазенов увеличивается с увеличением числа групп P=N[6], достигая значения pKBH+ = 41.9 у тетрафосфазена t-Bu-P4
-
t-Bu-P4
-
BEMP
Ввиду сочетания крайне высокой основности с очень низкой нуклеофильностью полиаминофосфазены нашли применение в органическом синтезе в качестве супероснований[7].
Синтез
В препаративной практике используется две основных группы метода формирования связи P=N и, соответственно, синтеза фосфазенов: замещением галогенов или других уходящих групп при взаимодействии фосфоранов с аминами и амидами и иминирование соединений трехвалентного фосфора, обычно фосфинов.
Фосфазены из фосфоранов
Исторически первым методом синтеза фосфазенов была реакция пентахлорида фосфора с аммиаком, описанная Либихом и Велером в 1834 г., они выделили с небольшим выходом из реакционной смеси кристаллическое вещество с четкой температурой плавления[8], брутто-формула которого (NPCl2)3 была определена лишь три десятилетия спустя[9].
Аммонолиз пентахлорида фосфора хлоридом аммония используется и в настоящее время в промышленном синтезе циклических и полимерных хлорфосфазенов:
- n PCl5 + n NH4Cl [math]\displaystyle{ \to }[/math] (-N=PCl2-)n + 4n HCl
при этом образуется смесь продуктов, соотношение которых зависит от условий проведения реакции. При температурах ниже 200 °С основным продуктом является гексахлорциклотрифосфазен (NPCl2)3, который при повышении температуры полимеризуется с раскрытием цикла в линейный высокомолекулярнйй эластомерный полихлорфосфазен.
Препаративным методом синтеза мономерных фосфазенов является взаимодействие галогенфосфоранов с первичныими аминами либо амидами (реакция Кирсанова):
- X3PHal2 + RNH2 [math]\displaystyle{ \to }[/math] X3P=NR + 2 HHal
- Alk, Ar, R'CO, AlkSO2, P(O)Alk2; Hal=Cl, Br; X=F, Cl, Вr
В качестве фосфоранового компонента в первоначальном варианте реакции Кирсанова использовался пентахлорид фосфора, в дальнейшем было показано, что с аминами и амидами аналогичным образом реагируют и квазифосфониевые соли - аддукты фосфинов с галогенами:
- R3P+Hal Hal- + R'NH2 [math]\displaystyle{ \to }[/math] R3P=NR' + 2 HHal
Фосфазены из соединений трехвалентного фосфора
Наиболее распространенным методом синтеза фосфазенов из фосфинов является их взаимодействие с азидами (реакция Штаудингера), в препаративной практике эта реакция зачастую используется фосфазен:
Аналогичный образом протекает взаимодействие азидов с фосфитами P(OR)3 и амидофосфиты P(N(R2))3.
Другим методом синтеза является взаимодействие фосфинов с N-хлораминами и хлорамидами:
- R3P + R'NHCl [math]\displaystyle{ \to }[/math] R3P=NR' + HCl
Примечания
- ↑ phosphazenes // IUPAC Gold Book. Дата обращения: 11 марта 2013. Архивировано 22 октября 2012 года.
- ↑ Bullen, G. J. An improved determination of the crystal structure of hexachlorocyclotriphosphazene (phosphonitrilic chloride) (англ.) // Journal of the Chemical Society[англ.] : journal. — Chemical Society, 1971. — 1 January (no. 0). — P. 1450—1453. — ISSN 0022-4944. — doi:10.1039/J19710001450. Архивировано 4 марта 2016 года.
- ↑ Cruickshank, D. W. J. Refinements of structures containing bonds between Si, P, S or Cl and O or N. I. NaPO3NH3 (англ.) // Acta Crystallographica[англ.] : journal. — International Union of Crystallography, 1964. — 1 June (vol. 17, no. 6). — P. 671—672. — ISSN 0365-110X. — doi:10.1107/S0365110X64001633. Архивировано 2 июня 2018 года.
- ↑ Phosphazene Bases. Sigma-Aldrich. Дата обращения: 27 апреля 2017. Архивировано 28 апреля 2017 года.
- ↑ 2-tert-Butylimino-2-diethylamino-1,3-dimethylperhydro-1,3,2-diazaphosphorine
- ↑ Schwesinger, Reinhard; Schlemper, Helmut. Peralkylated Polyaminophosphazenes— Extremely Strong, Neutral Nitrogen Bases (англ.) // Angewandte Chemie International Edition : journal. — 1987. — 1 November (vol. 26, no. 11). — P. 1167—1169. — ISSN 1521-3773. — doi:10.1002/anie.198711671. Архивировано 28 апреля 2017 года.
- ↑ Ishikawa, Tsutomu. Superbases for Organic Synthesis: Guanidines, Amidines, Phosphazenes and Related Organocatalysts (англ.). — John Wiley & Sons, 2009. — ISBN 978-0-470-74086-6.
- ↑ J. Liebig, Ann. Chem. 11, 139 (1834)
- ↑ J. H. Gladstone and J. D. Holmes, J. Chem. Soc., London 17, 225 (1864)