Химия
| Наука | |
| Химия | |
|---|---|
| англ. Chemistry | |
| Тема | Естествознание |
| Предмет изучения | элементы, соединения, вещества |
| Период зарождения | XVIII век |
| Основные направления | неорганическая химия, органическая химия, биохимия |
Хи́мия (от араб. کيمياء, произошедшего, предположительно, от египетского слова Кемет (транслит. егип. Kmt) (чёрный), откуда возникло также название Египта, чернозёма и свинца — Та-Кемет — «чёрная земля» (егип. tA-kmt)[1][2][3]; другие возможные варианты: др.-греч. χυμος — „сок“, „эссенция“, „влага“, „вкус“, др.-греч. χυμα — „сплав (металлов)“, „литьё“, „поток“, др.-греч. χυμευσις — „смешивание“) — одна из важнейших и обширных областей естествознания, наука, изучающая вещества, также их состав и строение, их свойства, зависящие от состава и строения, их превращения, ведущие к изменению состава — химические реакции, а также законы и закономерности, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается, прежде всего, рассмотрением перечисленных выше задач на атомно-молекулярном уровне, то есть на уровне химических элементов и их соединений. Химия имеет немало связей с физикой и биологией, по сути граница между ними условна[4], а пограничные области изучаются квантовой химией, химической физикой, физической химией, геохимией, биохимией и другими науками. Является экспериментальной наукой.
История химии
Этот раздел должен быть полностью переписан. |
Зачатки химии возникли ещё со времён появления человека. Поскольку человек всегда, так или иначе, имел дело с химическими веществами, его первые эксперименты с огнём, дублением шкур, приготовлением пищи можно назвать зачатками практической химии. Постепенно практические знания накапливались, и в самом начале развития цивилизации люди умели готовить некоторые краски, эмали, яды и лекарства. Вначале человек использовал биологические процессы, такие, как брожение, гниение; позже, с освоением огня, начал использовать процессы горения, спекания, сплавления. Использовались окислительно-восстановительные реакции, не протекающие в живой природе — например, восстановление металлов из их соединений.
Такие ремёсла, как металлургия, гончарство, стеклоделие, крашение, парфюмерия, косметика, достигли значительного развития ещё до начала нашей эры. Например, состав современного бутылочного стекла практически не отличается от состава стекла, применявшегося в 4000 году до н. э. в Египте. Хотя химические знания тщательно скрывались жрецами от непосвящённых, они всё равно медленно проникали в другие страны. К европейцам химическая наука попала главным образом от арабов после завоевания ими Испании в 711 году. Они называли эту науку „алхимией“, от них это название распространилось и в Европе.
Известно, что в Египте уже в 3000 году до н. э. умели получать медь из её соединений, используя древесный уголь в качестве восстановителя, а также получали серебро и свинец. Постепенно в Египте и Месопотамии было развито производство бронзы, а в северных странах — железа. Делались также теоретические находки. Например, в Китае с XXII века до н. э. существовала теория об основных элементах (Вода, Огонь, Дерево, Золото, Земля). В Месопотамии возникла идея о противоположностях, из которых построен мир: огонь—вода, тепло—холод, сухость—влажность и т. д.
В V веке до н. э. в Греции Левкипп и Демокрит развили теорию о строении вещества из атомов — атомизм. По аналогии со строением письма они заключили, что как речь делится на слова, а слова состоят из букв, так и все вещества состоят из определённых соединений (молекул), которые в свою очередь состоят из неделимых элементов (атомов).
В V веке до н. э. Эмпедокл предложил считать основными элементами (стихиями) Воду, Огонь, Воздух и Землю. В IV веке до н. э. Платон развил учение Эмпедокла: каждому из этих элементов соответствовал свой цвет и своя правильная пространственная фигура атома, определяющая его свойства: огню — красный цвет и тетраэдр, воде — синий и икосаэдр, земле — зелёный и гексаэдр, воздуху — жёлтый и октаэдр. По мнению Платона, именно из комбинаций этих „кирпичиков“ и построен весь материальный мир. Учение о четырёх превращающихся друг в друга было унаследовано Аристотелем.
Алхимия
Слово „алхимия“ попало в европейские языки из араб. الخيمياء (’al-kīmiyā’), которое, в свою очередь, было заимствовано из среднегреческого χυμεία „флюид“.
Культура Египта обладала хорошо развитыми технологиями, что демонстрируют объекты и сооружения, создание которых возможно только при наличии теоретической и практической базы. Подтверждение развития первичных теоретических знаний в Египте наука получает в последнее время. Тем не менее, на такое происхождение указывает, в большей степени эзотерическую, концептуальную принадлежность имеющие подобия теоретических — традиционные источники алхимии — этого причудливого и цветистого „симбиоза“ искусства и, в определённой степени — примата одного из основных разделов естествознания — химии, только формально берущей начало в этом комплексе знаний и опыта. Среди таких источников в первую очередь следует назвать — „Изумрудную скрижаль“ (лат. «Tabula smaragdina») Гермеса Трисмегиста, как и ряд других трактатов „Большого алхимического свода“[5][6].
Имел место ещё в IV—III веках до н. э. на Востоке (в Индии, Китае, в арабском мире) ранний „прототип“ алхимии. В этот и последующие периоды были найдены новые способы получения таких элементов как ртуть, сера, фосфор, охарактеризованы многие соли, уже были известны и использовались кислота HNO3 и щёлочь NaOH. С раннего Средневековья получает развитие то, что сейчас принято понимать под алхимией, в которой традиционно соединились, наряду с вышеназванными наукообразными компонентами (в смысле современного понимания методологии науки), философские представления эпохи и новые для того времени ремесленные навыки, а также магические и мистические представления; последними, впрочем, и была наделена в отдельных своих проявлениях и особенностях философская мысль той поры. Известными алхимиками того времени были Джабир ибн Хайян (Гебер), Ибн Сина (Авиценна) и Абу Бакр ар-Рази. Ещё в античности, благодаря интенсивному развитию торговли, золото и серебро становятся всеобщим эквивалентом производимых товаров. Трудности, с которыми связано получение этих сравнительно редких металлов, побудили к попыткам практического использования натурфилософских воззрений Аристотеля о преобразовании одних веществ в другие; возникновение учения о „трансмутации“, вместе с уже названным Гермесом Трисмегистом, традиция алхимической школы связывала и с его именем. Представления эти претерпели мало изменений вплоть до XIV века[5][6].

В VII веке н. э. алхимия проникла в Европу. В то время, как и на протяжении всей истории, у представителей господствовавших слоёв общества особой „популярностью“ пользовались предметы роскоши, в особенности — золото, поскольку именно оно являлось, как уже отмечено, эквивалентом торговой оценки. Алхимиков, в числе прочих вопросов, продолжали интересовать способы получения золота из других металлов, а также проблемы их обработки. Вместе с тем, к тому времени арабская алхимия стала отдаляться от практики и утратила влияние. Из-за особенностей технологий, обусловленных, в числе прочего — системой герметических взглядов, различием знаковых систем, терминологии и сугубо корпоративного распространения знаний „алхимическое действо“ развивалось очень медленно. Наиболее известными европейскими алхимиками считаются Никола Фламель, Альберт Великий, Джон Ди, Роджер Бэкон и Раймонд Луллий. Эпоха алхимиков ознаменовала получение многих первичных веществ, разработку способов их получения, выделения и очистки. Только в XVI веке, с развитием различных производств, в том числе металлургии, а также фармацевтики, обусловленным возрастанием её роли в медицине, начали появляться исследователи, чья деятельность выразилась существенными преобразованиями в этой науке, которые приблизили становление хорошо осмысленных и актуальных практических методов этой дисциплины. Среди них, прежде всего, следует назвать Георгия Агриколу и Теофраста Бомбаста Парацельса[5][6].
Химия как наука
Химия как самостоятельная дисциплина определилась в XVI—XVII веках, после ряда научных открытий, обосновавших механистическую картину мира, развития промышленности, появления буржуазного общества. Однако из-за того, что химия, в отличие от физики, не могла быть выражена количественно, существовали споры, является ли химия количественной воспроизводимой наукой или это некий иной вид познания. В 1661 году Роберт Бойль создал труд „Химик-скептик“, в котором объяснил разность свойств различных веществ тем, что они построены из разных частиц (корпускул), которые и отвечают за свойства вещества. Ван Гельмонт, изучая горение, ввёл понятие газ для вещества, которое образуется при нём, открыл углекислый газ. В 1672 году Бойль открыл, что при обжиге металлов их масса увеличивается, и объяснил это захватом „весомых частиц пламени“.
М. В. Ломоносов уже в первой известной своей работе, именно к данной области естествознания отношение имеющей — „Элементы математической химии“ (1741), в отличие от большинства химиков своего времени, считавших эту сферу деятельности искусством, классифицирует её как науку, начиная свой труд словами[7]:
Химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное. ...Не сомневаюсь, что найдутся многие, которым это определение покажется неполным, будут сетовать на отсутствие начал разделения, соединения, очищения и других выражений, которыми наполнены почти все химические книги; но те, кто проницательнее, легко усмотрят, что упомянутые выражения, которыми весьма многие писатели по химии имеют обыкновение обременять без надобности свои исследования, могут быть охвачены одним словом: смешанное тело. В самом деле, обладающий знанием смешанного тела может объяснить все возможные изменения его, и в том числе разделение, соединение и т. д.
Тепло и флогистон. Газы
В начале XVIII века Шталь сформулировал теорию флогистона — вещества, удаляющегося из материалов при их горении.
В 1749 году М. В. Ломоносов написал „Размышления о причине теплоты и холода“ (замысел работы относится к 1742—1743 годам — см. его же „Заметки по физике и корпускулярной философии“). Высочайшую оценку этому труду дал Л. Эйлер (письмо 21 ноября 1747 года). В 1848 году профессор Д. М. Перевощиков, обстоятельно излагая важнейшие идеи М. В. Ломоносова, подчёркивает, что его теория теплоты опередила науку на полстолетия („Современник“, январь 1848, т. VII, кн. 1, отд. II, с. 41—58) — со мнением этим, до того и в дальнейшем, согласуется мнение многих других исследователей[7].
В 1754 году Блэк открыл углекислый газ, Пристли в 1774 — кислород, а Кавендиш в 1766 — водород.
В период 1740—1790 годов Лавуазье и Ломоносов[7] химически объяснили процессы горения, окисления и дыхания, доказали, что огонь — не вещество, а следствие процесса. Пруст в 1799—1806 годах сформулировал закон постоянства состава. Гей-Люссак в 1808 открыл закон объёмных отношений (закон Авогадро). Дальтон в труде „Новая система химической философии“ (1808—1827) доказал существование атомов, ввёл понятие атомный вес, элемент — как совокупность одинаковых атомов.
Реинкарнация атомарной теории вещества
В 1811 году Авогадро выдвинул гипотезу о том, что молекулы элементарных газов состоят из двух одинаковых атомов; позднее на основе этой гипотезы Канниццаро осуществил реформу атомно-молекулярной теории. Эта теория была утверждена на первом международном съезде химиков в Карлсруэ 3-5 сентября 1860 года.

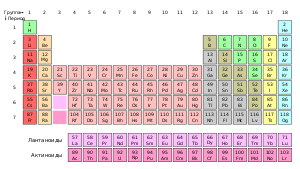
В 1869 году Д. И. Менделеев открыл периодический закон химических элементов и создал периодическую систему химических элементов. Он объяснил понятие химический элемент и показал зависимость свойств элемента от атомной массы. Открытием этого закона он основал химию как количественную науку, а не только как описательную и качественную.
Радиоактивность и спектры
Важную роль в познании структуры вещества сыграли открытия XIX века. Исследование тонкой структуры эмиссионных спектров и спектров поглощения натолкнуло учёных на мысль о их связи со строением атомов веществ. Открытие радиоактивности показало, что некоторые атомы нестабильны (изотопы) и могут самопроизвольно превращаться в новые атомы (радон — „эманация“).
Квантовая химия
- Основная статья: Квантовая химия
Квантовая химия — это направление химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др.[8] Квантовая химия находится на стыке химии и квантовой физики (квантовой механики). Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне (моделях электронно-ядерного строения и взаимодействий, представленных с точки зрения квантовой механики). Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближённые методы расчёта. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для составления специальных компьютерных программ, используемых для расчёта молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции молекулярного поведения.
Основные понятия
Элементарная частица
- Основная статья: Элементарная частица
Это все частицы, не являющиеся атомными ядрами или атомами (протон — исключение). В узком смысле — частицы, которые нельзя считать состоящими из других частиц (при заданной энергии воздействия/наблюдения). Элементарными частицами также являются электроны (-), протоны (+) и нейтроны.
Атом
- Основная статья: Атом
Наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и „облака“ электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы.
Атом — предел химического разложения любого вещества. Простое вещество (если оно не является одноатомным, как, например, гелий He) разлагается на атомы одного вида, сложное вещество — на атомы разных видов.
Атомы (точнее, атомные ядра) неделимы химическим путём.
Молекула

Частица, состоящая из двух или более атомов, которая может самостоятельно существовать. Имеет постоянный качественный и количественный состав. Свойства молекулы зависят от атомов, входящих в её состав, и от характера связей между ними, от молекулярной структуры и от пространственного расположения (изомеры). Может иметь несколько разных состояний и переходить от одного состояния к другому под действием внешних факторов. Свойства вещества, состоящего из определённых молекул, зависят от состояния молекул и от свойств молекулы.
Вещество
- Основная статья: Вещество
В соответствии с классическими научными воззрениями различаются две физические формы существования материи — вещество и поле. Вещество — это форма материи, обладающая массой (масса не равна нулю). Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Те, в свою очередь, состоят из элементарных частиц: электронов, протонов, нейтронов и т. д.
Простые и сложные вещества. Химические элементы
Среди чистых веществ принято различать простые (состоящие из атомов одного химического элемента) и сложные (образованы из атомов нескольких химических элементов) вещества.
Простые вещества следует отличать от понятий „атом“ и „химический элемент“.
Химический элемент — это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
- Основная статья: Химический элемент
Простые вещества представляют собой формы существования химических элементов в свободном виде; каждому элементу соответствует, как правило, несколько простых веществ (аллотропных форм), которые могут различаться по составу, например атомный кислород O, кислород O2 и озон O3, или по кристаллической решётке, например алмаз и графит для элемента углерод C. Очевидно, что простые вещества могут быть одно- и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин означает, что вещества могут быть получены с помощью химических реакций соединения из простых веществ (химического синтеза) или разделены на элементы в свободном виде (простые вещества) с помощью химических реакций разложения (химического анализа).
Простые вещества представляют собой конечные формы химического разложения сложных веществ. Сложные вещества, образующиеся из простых веществ, не сохраняют химические свойства составляющих веществ.
Суммируя всё сказанное выше, можно записать:
[math]\displaystyle{ E \overset S \underset A \rightleftarrows C }[/math], где
E — простые вещества (элементы в свободном виде),
C — сложные вещества (химические соединения),
S — синтез,
A — анализ.
В настоящее время понятия „синтез“ и „анализ“ химических веществ используются в более широком смысле. К синтезу относят любой химический процесс, который приводит к получению необходимого вещества и при этом существует возможность его выделения из реакционной смеси. Анализом считается любой химический процесс, позволяющий определить качественный и количественный состав вещества или смеси веществ, то есть установить, из каких элементов составлено данное вещество и каково содержание каждого элемента в этом веществе. Соответственно различают качественный и количественный анализ — две составные части одной из химических наук — аналитической химии.
Металлы и неметаллы
Все химические элементы по их свойствам, то есть свойствам свободных атомов и свойствам образуемых элементами простых и сложных веществ, делят на металлические и неметаллические элементы. Условно к неметаллам относят элементы He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, N, P, C и H. К полуметаллам относят B, Si, Ge, As, Sb, Te, иногда — Po. Остальные элементы считаются металлами.
Чистые вещества и смеси веществ
Индивидуальное чистое вещество обладает определённым набором характеристических свойств. От чистых веществ следует отличать смеси веществ, которые могут состоять из двух или большего числа чистых веществ, сохраняющих присущие им свойства.
Смеси веществ делятся на гомогенные (однородные) и гетерогенные (неоднородные).
| Агрегатное состояние составных частей
(до образования смеси) |
Гомогенная смесь
(гомогенная система) |
Гетерогенная смесь
(гетерогенная система) |
|---|---|---|
| Твёрдое — твёрдое | Твёрдые растворы, сплавы (например латунь, бронза) | Горные породы (например гранит, минералосодержащие руды и др.) |
| Твёрдое — жидкое | Жидкие растворы (например, водные растворы солей) | Твёрдое в жидком — суспензии или взвеси (например, частицы глины в воде, коллоидные растворы) |
| Жидкое в твёрдом — жидкость в пористых телах (например, почвы, грунты) | ||
| Твёрдое — газообразное | Хемосорбированный водород в платине, палладии, сталях | Твёрдое в газообразном — порошки, аэрозоли, в том числе дым, пыль, смог |
| Газообразное в твёрдом — пористые материалы (например, кирпич, пемза) | ||
| Жидкое — твёрдое | Твёрдые жидкости (например, стекло — твёрдое, но всё же жидкость) | Может принимать разную форму и фиксировать её (например, посуда — разной формы и цвета) |
| Жидкое — жидкое | Жидкие растворы (например, уксус — раствор уксусной кислоты в воде) | Двух- и многослойные жидкие системы, эмульсии (например, молоко — капли жидкого жира в воде) |
| Жидкое — газообразное | Жидкие растворы (например, раствор диоксида углерода в воде) | Жидкое в газообразном — аэрозоли жидкости в газе, в том числе туманы |
| Газообразное в жидком — пены (например, мыльная пена) | ||
| Газообразное — газообразное | Газовые растворы (смеси любых количеств и любого числа газов), напр. воздух. | Гетерогенная система невозможна |
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздроблённом состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твёрдых веществ, например сплавы.
В гетерогенных смесях либо визуально, либо с помощью оптических приборов можно различить области (агрегаты) разных веществ, разграниченные поверхностью раздела; каждая из этих областей внутри себя гомогенна. Такие области называются фазой.
Гомогенная смесь состоит из одной фазы, гетерогенная смесь состоит из двух или большего числа фаз.
Гетерогенные смеси, в которых одна фаза в виде отдельных частиц распределена в другой, называются дисперсными системами. В таких системах различают дисперсионную среду (распределяющую среду) и дисперсную фазу (раздроблённое в дисперсионной среде вещество).
С помощью физических методов разделения можно провести разделение смесей на их составные части, то есть на чистые вещества.
| Агрегатное состояние составных частей смеси | Физическое свойство, используемое для разделения | Метод разделения |
|---|---|---|
| Твёрдое — твёрдое | Плотность | Отстаивание, седиментация |
| Смачиваемость | Флотация, пенная флотация | |
| Размер частиц | Просеивание | |
| Растворимость | Экстракция, выщелачивание | |
| Магнетизм | Магнитная сепарация | |
| Твёрдое — жидкое | Плотность | Седиментация, декантация (сливание жидкости с осадка), центрифугирование |
| Температура кипения жидкости | Выпаривание, дистилляция, осушка | |
| Размер частиц | Фильтрование | |
| Растворимость твёрдого вещества | Кристаллизация | |
| Твёрдое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Размер частиц | Фильтрование | |
| Электрический заряд | Электрофильтрование | |
| Жидкое — жидкое | Плотность | Отстаивание (в делительной воронке, в маслоотделителе), центрифугирование |
| Температура кипения | Дистилляция | |
| Растворимость | Экстракция | |
| Жидкое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Растворимость газа | Отгонка газа (путём повышения температуры), промывание с помощью другой жидкости | |
| Газообразное — газообразное | Температура конденсации | Конденсация |
| Абсорбируемость | Абсорбция (поглощение объёмом сорбента) | |
| Адсорбируемость | Адсорбция (поглощение поверхностью сорбента) | |
| Размер частиц | Диффузия | |
| Масса | Центрифугирование |
Чистыми веществами называются вещества, которые при проведении физических методов не разделяются на два или более других веществ и не изменяют своих физических свойств.
В природе не существует абсолютно чистых веществ. Например, так называемый особо чистый алюминий ещё содержит 0,001 % примесей других веществ. Таким образом, абсолютно чистое вещество — это абстракция. Правда, когда речь идёт о каком-либо веществе, то химия пользуется этой абстракцией, то есть считает, что вещество истинно чистое, хотя практически берётся вещество с некоторым содержанием примесей. Конечно, химик должен стремиться использовать в своей практике по возможности чистые вещества, содержащие минимальное количество примесей. Следует учитывать, что даже незначительное содержание примесей может существенно изменить химические свойства вещества.
| Смесь | Сложное вещество |
|---|---|
| Образуется с помощью физического процесса (смешивание чистых веществ) | Образуется с помощью химической реакции (синтез из простых веществ) |
| Свойства чистых веществ, из которых составлена смесь, остаются неизменными | Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются |
| Чистые вещества (простые и сложные) могут находиться в смеси в любом массовом соотношении | Элементы, входящие в состав сложного вещества, всегда находятся в определённом массовом отношении |
| Может быть разделена на составные части (чистые вещества) с помощью физических методов | Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ) |
Ион
Это заряженная частица, атом или молекула, которая имеет неодинаковое количество протонов и электронов. Если у частицы больше электронов, чем протонов, то она заряжена отрицательно и называется анион. Например — Cl−. Если в частице электронов меньше, чем протонов, значит, она заряжена положительно и называется катион. Например — Na+.
Радикал
Это частица (атом или молекула), содержащая один или несколько неспаренных электронов. В большинстве случаев химическая связь образуется при участии двух электронов. Частица, имеющая неспаренный электрон, очень активна и легко образует связи с другими частицами. Поэтому время жизни радикала в среде, как правило, очень мало.
- См. также о свободных радикалах при радиолизе в радиобиологии.
Химическая связь
Удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, водородную.
Периодический закон
Открыт Д. И. Менделеевым 1 марта 1869 года. Современная формулировка: Свойства элементов, а также образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Химические реакции
Процессы, протекающие в химическом веществе, или в смесях различных веществ, представляют собой химические реакции. При протекании химических реакций всегда образуются новые вещества.
В сущности это процесс изменения структуры молекулы. В результате реакции количество атомов в молекуле может увеличиваться (синтез), уменьшаться (разложение) или оставаться постоянным (изомеризация, перегруппировка). В ходе реакции изменяются связи между атомами и порядок размещения атомов в молекулах.
Химические реакции выявляют и характеризуют химические свойства данного вещества.
Исходные вещества, взятые для проведения химической реакции, называются реагентами, а новые вещества, образующиеся в результате химической реакции, — продуктами реакции. В общем виде химическая реакция изображается так:
Реагенты → Продукты
Химия изучает и описывает эти процессы как в макромасштабе, на уровне макроколичеств веществ, так и в микромасштабе, на атомно-молекулярном уровне. Внешние проявления химических процессов, протекающих в макромасштабе, нельзя непосредственно перенести на микроуровень взаимодействия веществ и однозначно их интерпретировать, однако такие переходы возможны при правильном использовании специальных химических законов, присущих только микрообласти (атомам, молекулам, ионам, взятым в единичных количествах).
Номенклатура
Это свод правил наименования химических соединений. Поскольку общее число известных соединений больше 20 млн, и их число принципиально неограниченно, необходимо пользоваться чёткими правилами при их наименовании, чтобы по названию можно было воспроизвести их структуру. Существует несколько вариантов наименования органических и неорганических соединений, но стандартом считается номенклатура IUPAC.
Разделы химии
Современная химия — настолько обширная область естествознания, что многие её разделы по существу представляют собой самостоятельные, хотя и тесно взаимосвязанные научные дисциплины.
По признаку изучаемых объектов (веществ) химию принято делить на неорганическую и органическую. Объяснением сущности химических явлений и установлением их общих закономерностей на основе физических принципов и экспериментальных данных занимается физическая химия, включающая квантовую химию, электрохимию, химическую термодинамику, химическую кинетику. Самостоятельными разделами являются также аналитическая и коллоидная химия (см. ниже перечень разделов).
Технологические основы современных производств излагает химическая технология — наука об экономичных методах и средствах промышленной химической переработки готовых природных материалов и искусственного получения химических продуктов, не встречающихся в окружающей природе.
Сочетание химии с другими смежными естественными науками представляют собой биохимия, биоорганическая химия, геохимия, радиационная химия, фотохимия и др.
Общенаучные основы химических методов разрабатываются в теории познания и методологии науки.
- Агрохимия
- Аналитическая химия занимается изучением веществ с целью получить представление об их химическом составе и структуре, в рамках этой дисциплины ведётся разработка экспериментальных методов химического анализа.
- Биоорганическая химия
- Биохимия изучает химические вещества, их превращения и явления, сопровождающие эти превращения в живых организмах. Тесно связана с органической химией, химией лекарственных средств, нейрохимией, молекулярной биологией и генетикой.
- Вычислительная химия
- Геохимия — наука о химическом составе Земли и планет (космохимия), законах распределения элементов и изотопов, процессах формирования горных пород, почв и природных вод.
- Квантовая химия
- Коллоидная химия
- Компьютерная химия
- Косметическая химия
- Космохимия
- Математическая химия
- Материаловедение
- Медицинская химия
- Металлоорганическая химия
- Нанохимия
- Неорганическая химия изучает свойства и реакции неорганических соединений. Чёткой границы между органической и неорганической химии нет, напротив, существуют дисциплины на стыке этих наук, например, металлоорганическая химия.
- Органическая химия выделяет в качестве предмета изучения вещества, построенные на основе углеродного скелета.
- Нейрохимия своим предметом имеет изучение медиаторов, пептидов, белков, жиров, сахара и нуклеиновых кислот, их взаимодействия и роли, которую они играют в формировании, становлении и изменении нервной системы.
- Нефтехимия
- Общая химия
- Препаративная химия
- Радиохимия
- Супрамолекулярная химия
- Фармацевтика
- Физическая химия изучает физический и фундаментальный базис химических систем и процессов. Важнейшие области исследования включают химическую термодинамику, кинетику, электрохимию, статистическую механику и спектроскопию. Физическая химия имеет много общего с молекулярной физикой. Физическая химия предполагает использование инфинитезимального метода. Физическая химия является отдельной дисциплиной от химической физики.
- Фотохимия
- Химия высокомолекулярных соединений
- Химия одноуглеродных молекул
- Химия полимеров
- Химия почв
- Теоретическая химия своей задачей ставит теоретическое обобщение и обоснование знаний химии через фундаментальные теоретические рассуждения (как правило, в области математики или физики).
- Термохимия
- Токсикологическая химия
- Электрохимия
- Экологическая химия; химия окружающей среды
- Ядерная химия изучает ядерные реакции и химические последствия ядерных реакций.
Химическая технология
Методы физико-химического анализа
См. сравнение и полную классификацию методов анализа в основной статье Аналитическая химия, а также в частности:

См. также
Примечания
- ↑ О. Либкин. Словарь науки. Химия. Журнал «Химия и жизнь. 1967. № 1. С.28.
- ↑ С. И. Фингарет. Искусство Древнего Египта в собрании Эрмитажа / Государственный Эрмитаж. — Л.: Аврора, 1970. — С. 19. — 72 с.
- ↑ И. П. Магидович, В. И. Магидович, В. С. Преображенский. Очерки по истории географических открытий: издание в пяти томах. — М.: Просвещение, 1982. — С. 13. — 292 с.
- ↑ Философия науки под ред. А. И. Липкина М.: Эксмо, 2007
- ↑ 5,0 5,1 5,2 Возникновение и развитие химии с древнейших времён до XVIII века. Всеобщая история химии. М.: Наука. 1989
- ↑ 6,0 6,1 6,2 Рабинович В. Л. Алхимия как феномен средневековой культуры. М.: Наука. 1979
- ↑ 7,0 7,1 7,2 Михаил Васильевич Ломоносов. Избранные произведения. В двух томах. Т. 1. Естественные науки и философия. — М.: Наука. 1986
- ↑ Давтян О. К. Квантовая химия. — М.: Высшая школа, 1962. — 784 с. — стр. 5
Литература
- Менделеев Д. И. Периодический закон: В 3 т. на сайте Руниверс
- Некрасов Б. В. Основы общей химии, т. 1. — М.: „Химия“, 1973
- Химическая энциклопедия, п. ред. Кнунянц И. Л., т. 5. — М.: „Советская энциклопедия“, 1988
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
- Джон Мур. Химия для чайников = Chemistry For Dummies. — М.: «Диалектика», 2011. — 320 с. — ISBN 978-5-8459-1773-7.
- Н. Л. Глинка. Общая химия. — М.: Интеграл-Пресс, 2008. — С. 728. — ISBN 5-89602-017-1.
- Джуа М. История химии. — М.: Мир, 1966. — 452 с.
- Дубинская А. М., Призмент Э. Л. Химические энциклопедии, в кн.: Химический энциклопедический словарь. — М., 1983
- Потапов В. М., Кочетова Э. К. Химическая информация. Где и как искать химику нужные сведения. — М., 1988
- Аблесимов Н. Е. Химия — это плохо? http://shkolazhizni.ru/world/articles/52420/
- Кузнецов В. И. Общая химия: тенденции развития. М.: Высшая школа,
- Аблесимов Н. Е. Сколько на свете химий? // Химия и жизнь — XXI век. 2009. № 5. С. 49-52; № 6. С. 34-37.
- Ахметов, Н. С. Общая и неорганическая химия. Общая неорганическая химия. Учеб. для вузов.-4-е изд., испр.,-М,: Высшая школа, Изд. центр» Академия", 2001.-743 с., ил., 2001.
- Мелентьева, Галина Александровна. Фармацевтическая химия. Рипол Классик, 1985.
- Николаев Л. А. Химия жизни. — М., Просвещение, 1977. — 239 c.
- Э. Гроссе, Х. Вайсмантель Химия для любознательных. — Л., Химия, 1987. — 392 c.
