Хлорноватистая кислота
| Хлорноватистая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорноватистая кислота |
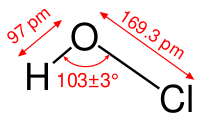
| Хим. формула | HClO |
| Физические свойства | |
| Состояние | Жидкое |
| Молярная масса | 52.46 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] | 7.497 |
| Классификация | |
| Рег. номер CAS | 7790-92-3 |
| SMILES | |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорнова́тистая кислота́ (химическая формула — HOCl или HClO) — слабая неорганическая кислота, образующаяся при растворении хлора в воде. Сам хлор частично диссоциирует с образованием гипохлорит-ионов (ClO-).
При стандартных условиях, хлорноватистая кислота — это бесцветный водный раствор.
HClO и ClO- — окислители и основные дезинфицирующие средства хлорных растворов. Хлорноватистую кислоту нельзя выделить из этих растворов из-за быстрого уравновешивания с его предшественником. Гипохлорит натрия и гипохлорит кальция являются отбеливателями, дезодорантами и дезинфицирующими средствами.
Химические свойства
В водных растворах хлорноватистая кислота частично распадается на протон (катион) [math]\displaystyle{ \mathsf H^+ }[/math] и гипохлорит-анион [math]\displaystyle{ \mathsf{ClO}^- }[/math]
- [math]\displaystyle{ \mathsf{HOCl \rightleftarrows\ ClO^- + H^+} }[/math]
Неустойчива, постепенно разлагается даже в разбавленных водных растворах на хлороводород и атомарный кислород[1], благодаря которому является сильным окислителем:
- [math]\displaystyle{ \mathsf{HOCl \rightarrow\ HCl + O} }[/math]
Взаимодействует с соляной кислотой с образованием газообразного хлора:
- [math]\displaystyle{ \mathsf{HOCl + HCl \rightarrow\ H_2O + Cl_2} }[/math]
Как и хлорноватистая кислота, её соли — гипохлориты — являются сильными окислителями. Многие из них неустойчивы. Кристаллогидрат [math]\displaystyle{ \mathsf{LiClO \cdot \ H_2O} }[/math] выдерживает длительное хранение; [math]\displaystyle{ \mathsf{NaClO \cdot \ H_2O} }[/math] при 70 °C разлагается со взрывом, а KClO известен только в виде водных растворов. [math]\displaystyle{ \mathsf{Ca(ClO)_2} }[/math] в сухом виде вполне устойчив, но в присутствии [math]\displaystyle{ \mathsf{H_2O} }[/math] и [math]\displaystyle{ \mathsf{CO_2} }[/math] разлагается. Более стоек [math]\displaystyle{ \mathsf{Mg(ClO)_2} }[/math].
Получение
Растворение хлора или оксида хлора(I) в воде (реакция диспропорционирования):
- [math]\displaystyle{ \mathsf{Cl_2 + H_2O \longrightarrow\ HClO + HCl} }[/math]
- [math]\displaystyle{ \mathsf{Cl_2O + H_2O \longrightarrow\ 2HClO} }[/math]
В промышленном масштабе производятся гипохлориты кальция, натрия, калия, лития (хлорированием известкового молока) и соответствующих щелочей.
Применение и безопасность
В органическом синтезе HClO превращает алкены в хлоргидрины. В биологии хлорноватистая кислота (ХВК) образуется в активированных нейтрофилах в результате опосредованного миелопероксидазой перекисного окисления хлорид-ионов и способствует разрушению бактерий. В сфере общественного питания и распределения воды специализированное оборудование для производства слабых растворов HClO из воды и соли иногда используется для производства достаточного количества безопасного (нестабильного) дезинфицирующего средства для обработки поверхностей для приготовления пищи и водоснабжения. При очистке воды хлорноватистая кислота является активным дезинфицирующим средством в продуктах на основе гипохлорита (например, используемых в плавательных бассейнах). Точно так же на кораблях и яхтах морские санитарные устройства используют электричество для преобразования морской воды в хлорноватистую кислоту для дезинфекции мацерированных фекальных отходов перед сбросом в море.
Хлорноватистая кислота исследовалась как возможное средство для ухода за ранами, и с начала 2016 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило продукты, основным активным ингредиентом которых является хлорноватистая кислота, для использования при лечении ран и различных инфекций у людей и домашних животных. Он также одобрен FDA в качестве консерванта для солевых растворов. В недавнем исследовании было показано, что солевой гигиенический раствор, консервированный чистой хлорноватистой кислотой, значительно снижает бактериальную нагрузку без изменения разнообразия видов бактерий на веках. После 20 минут лечения количество бактерий стафилококков уменьшилось на> 99%.
HOCl классифицируется Агентством по охране окружающей среды США как неопасный. При нейтральном pH (6.5), не вызывает коррозию или раздражение.
В 2015 году в США разработали технологию и оборудование, которые позволили наладить производство антисептиков на основе ХВК со сроком хранения два года. Продукция реализуется в США, Великобритании и Ирландии. В США помимо борьбы с микробами на коже средство используется в госпиталях для мытья стен и полов, в бассейнах вместо хлорки для подготовки воды.
В 2021 году на российском рынке также появились антисептики с хлорноватистой кислотой в виде активного вещества. В городе Дзержинском Московской области открылся завод по лицензии США (брэнд CleanSmart).
См. также
Примечания
- ↑ Н. В. Манкевич. Неорганическая химия. Весь школьный курс в таблицах. — 8-е. — Минск: «Букмастер» и «Кузьма», 2007. — С. 279. — 416 с.
Ссылки
- Тайна раскрыта: как отбеливатель убивает микробы.
- Антисептики нового поколения стали выпускать в Дзержинском.
- Чисто сработано: как устроено производство антибактериального средства.
Для улучшения этой статьи желательно: |
