Почка млекопитающего
| Почка млекопитающего | |
|---|---|
![Однососочковая многодолевая гладкая почка верблюда бобовидной формы, у которой почечные сосочки полностью объединены в почечный гребешок[1]](https://cdn.xn--h1ajim.xn--p1ai/thumb.php?f=Camel_kidney_%28longitudinal_cut%29.-_FMVZ_USP-30.jpg&width=268) Однососочковая многодолевая гладкая почка верблюда бобовидной формы, у которой почечные сосочки полностью объединены в почечный гребешок[1] Однососочковая многодолевая гладкая почка верблюда бобовидной формы, у которой почечные сосочки полностью объединены в почечный гребешок[1] | |
| Система | Выделительная система, эндокринная система |
| Кровоснабжение | Почечная артерия |
| Венозный отток | Почечная вена |
Почка млекопитающего — парный орган мочевыделительной системы млекопитающих, являющийся разновидностью метанефрической почки[2]. Почка у млекопитающих обычно бобовидной формы[3], расположена забрюшинно[4] на задней (дорсальной) стенке тела[5]. Каждая почка состоит из фиброзной оболочки, периферического коркового вещества, внутреннего мозгового вещества, а также чашек и почечной лоханки, однако чашечки или почечная лоханка у отдельных видов могут отсутствовать. Выводится моча из почки через мочеточник. Строение почки может различаться между видами в зависимости от среды обитания, в частности от её засушливости[6]. За фильтрацию крови ответственно корковое вещество, по своей сути оно аналогично типичным почкам менее развитых позвоночных[5]. Азотсодержащие продукты жизнедеятельности выделяются почками у млекопитающих преимущественно в виде мочевины[7].
В зависимости от вида почки могут быть однодолевыми или многодолевыми, однососочковыми, с несколькими сосочками или многососочковыми[8], могут быть с гладкой поверхностью или бороздчатыми[1][9], также почки могут быть множественными, множественные встречаются в основном у морских млекопитающих[10]. Наиболее простым типом почки у млекопитающих является однососочковая однодолевая почка[11][4]. К почкам млекопитающих также относятся почки человека.
Корковое и мозговое вещество почек содержит в себе нефроны[12]. У млекопитающих нефрон состоит из почечного клубочка в капсуле Боумена, проксимального извитого канальца, проксимального прямого канальца, петли Хенле и дистального извитого канальца[13], при этом нефроны разделяются на нефроны с короткой петлёй и с длинной[13]. Кровь, которая поступает в почки, фильтруется в почечных клубочках с выработкой первичной мочи в капсулы Боумена. Из них моча поступает в канальцы, где происходит её концентрация[14]. Вырабатывать концентрированную мочу могут только почки млекопитающих и птиц[5], но лишь у млекопитающих все нефроны содержат петлю Генле[15].
Почки млекопитающих являются жизненно-важными органами, которые поддерживают водно-электролитный балланс в организме, выводят азотистые продукты жизнедеятельности, регулируют артериальное давление и участвуют в формировании костей[16][17]. В почках происходят процессы фильтрации плазмы крови, канальцевой реабсорбции и канальцевой секреции, в результате этих процессов формируется моча[18]. Из числа гормонов в почках вырабатываются ренин[19] и эритропоэтин[20], также почки участвуют в преобразовании витамина D в его активную форму[21]. При этом млекопитающие являются единственным классом позвоночных, у которого за поддержание гомеостаза внеклеточной жидкости в организме отвечают одни лишь почки[22]. Регулируется деятельность почек вегетативной нервной системой и гормонами[23].
Структура
Расположение и форма
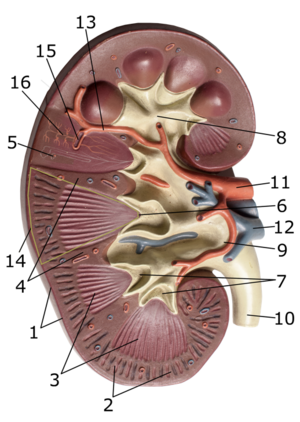
У млекопитающих почки обычно бобовидной формы[3], такая форма свойственна только млекопитающим[25]. Располагаются забрюшинно[4] на задней (дорсальной) стенке тела[26], при этом одним из ключевых факторов, которые определяют форму и морфологию почек у млекопитающих является их масса[27]. Вогнутая часть бобовидных почек называется почечными воротами. В них в почку входят почечная артерия и нервы, а выходят почечная вена, лимфатические сосуды и мочеточник[4][28]. Снаружи почка окружена массой жировой ткани[29].
Общее строение
Внешний слой каждой из почек состоит из фиброзной оболочки, называемой капсулой. Периферический слой почки представлен корковым веществом, а внутренний — мозговым. Мозговое вещество состоит из пирамид, восходящих своим основанием к корковому веществу и образующих вместе с ним почечную долю[30]. Пирамиды между собой разграничиваются почечными столбами (столбами Бертена), образованными корковой тканью[31]. Вершины пирамид оканчиваются почечными сосочками, из которых моча выводится в чашечки, в лоханку, мочеточник и мочевой пузырь[30][32], после чего она выводится наружу через мочеиспускательный канал[33].
Паренхима
Паренхима, будучи функциональной частью почек, визуально делится на корковое и мозговое вещество[34][35]. В основе коркового и мозгового вещества лежат нефроны[36][37] в совокупности с разветвлённой сетью кровеносных сосудов и капилляров, а также собирательные трубочки, в которые нефроны впадают, собирательные протоки и почечный интерстиций[38]. В корковом веществе расположена фильтрующая кровь часть нефрона — почечное тельце, от которого внутрь спускается почечный каналец, переходящий в мозговом веществе в петлю Генле, затем каналец возвращается назад в корковое вещество и своим дистальным концом впадает в общую для нескольких нефронов собирательную трубочку. Собирательные трубочки спускаются снова в мозговое вещество и объединяются в собирательные протоки, проходящие через внутреннее мозговое вещество[39][40].
Соотношение коркового к мозговому веществу варьируется между видами, у одомашненных животных корковое вещество обычно занимает третью или четвёртую часть толщины паренхимы, в то время как у пустынных животных с длинными петлями Генле — лишь пятую часть[9].
Корковое вещество
Структурно корковое вещество состоит из коркового лабиринта и мозговых лучей[41]. Корковый лабиринт содержит в себе междольковые артерии, сосудистые сети, образованные афферентными и эфферентными артериолами, почечные тельца, проксимальные извитые канальцы, плотные пятна (лат. macula densa), дистальные извитые канальцы, соединительные канальцы и начальные части собирательных трубочек[40]. Преобладают в корковом лабиринте проксимальные извитые канальцы[42]. Сплошной слой коркового вещества, лежащий над мозговыми лучами, называется корой коркового вещества (лат. cortex corticis)[41]. У некоторых млекопитающих есть нефроны, петли Генли которых не достигают мозгового вещества, такие нефроны называются корковыми[39]. Мозговые лучи коркового вещества содержат в себе проксимальные прямые канальцы, корковую часть восходящих толстых ветвей петли Генле и корковую часть собирательных трубочек[40]. При этом корковое вещество делится на дольки, каждая из которых представляет из себя мозговой луч в совокупности с ассоциированными с ним нефронами, а между дольками проходят междольковые артерии[43].
Мозговое вещество
Мозговое вещество у млекопитающих делится на наружную и внутреннюю зоны. Наружная зона состоит из коротких петлей Генле и собирательных трубочек, внутренняя — из длинных петлей и собирательных протоков[44]. Наружная зона, в свою очередь, также подразделяется на наружную[45] (лежащую прямо под корковым веществом)[40] и внутреннюю полосы[45]. Отличаются полосы тем, что в наружной присутствуют проксимальные прямые канальцы, а во внутренней — тонкие нисходящие части петли Генле (отдел нефрона, следующий за проксимальным прямым канальцем)[40].
Соотношение наружного и внутреннего мозгового вещества
У большинства видов есть нефроны и с короткими, и с длинными петлями, у отдельных же видов может быть лишь один тип. Например, у горных бобров есть только нефроны с короткой петлёй, и, соответственно, отсутствует внутреннее мозговое вещество. У собак и кошек, наоборот, есть только нефроны с длинными петлями. Соотношение нефронов с короткими петлями Генле к нефронам с длинными также варьируется между видами[46].
Структурные различия между видами

Структурно почки варьируются между млекопитающими[47]. То, какой структурный тип будет у того или иного вида, в основном зависит от массы тела животных[48]. У маленьких млекопитающих встречаются простые однодолевые почки с компактной структурой и одним почечным сосочком[47][49], в то время как у больших животных — почки многодолевые, как например, у крупного рогатого скота[47][50], при этом у крупного рогатого скота почки бороздчатые, визуально поделённые на доли[9]. Сама по себе доля равноценна простой однососочковой почке, как у крыс или мышей[42]. У крупного рогатого скота также отсутствует почечная лоханка, моча из больших чашек выводится напрямую в мочеточник[51].
По количеству почечных сосочков почки могут быть однососочковыми[52], как например у крыс и мышей[53], с несколькими почечными сосочками, как у паукообразных обезьян, или с большим количеством, как у свиней и человека[52]. У большинства животных один почечный сосочек[52]. У некоторых животных, например, у лошадей, окончания почечных пирамид сливаются друг с другом с образованием общего почечного сосочка, называемого почечным гребешком[54]. Почечный гребень обычно появляется у животных, размером больше кролика[55].
У морских млекопитающих, выдр и медведей почки множественные, состоящие из маленьких почечек[10], каждая из которых аналогична простой однодолевой почке[41]. Почки морских млекопитающих могут состоять из сотен почечек, у каждой из которых свои корковое и мозговое вещество и чашечка. У ламантин, тоже являющихся морскими млекопитающими, фактически почки многодолевые, поскольку корковое вещество сплошное[10].
Размеры почек увеличиваются с массой млекопитающих, а количество нефронов в почках между млекопитающими возрастает алометрически[56]. У мышей почки длиной примерно 1 см, массой 400 мг, c 16 000 нефронов, в то время как у косатки длина почки превышает 25 см, масса составляет примерно 4,5 кг, с количеством нефронов порядка 10 000 000. При этом почки косаток множественные, а каждая почечка сравнима с почкой мышей (длина почечки составляет 1 см, масса — примерно 430 мг). Множественные почки, вероятно, позволяют увеличивать количество нефронов добавлением отдельных почечек без необходимости увеличения длины канальцев. Альтернативным адаптационным механизмом является увеличение размера почечных клубочков у крупных млекопитающих (и, соответственно, увеличения длины канальцев), как например, в случае слонов, у которых диаметр клубочка может быть в 2 раза больше, чем у косаток[57].
Микроанатомия
С точки зрения микроанатомии почку структурно можно разделить на несколько основных элементов: почечные тельца, канальцы, интерстиций и сосудистая сеть[9]. Интерстиций представляет собой клетки и внеклеточный матрикс в пространстве между клубочками, сосудами, канальцами и трубочками[58][59]. Из-за отсутствия базальной мембраны частью интерстиция считаются также лимфатические капилляры[60]. Каждый нефрон с продолжающей его собирательной трубочкой и снабжающая нефрон сосудистая сеть встроены в интерстиций, образованный строматическими клетками[англ.]. Нефрон вместе с продолжающей его собирательной трубочкой называется мочевым канальцем (англ. uriniferous tubule)[9].
В почках млекопитающих описаны порядка 18—26 различных типов клеток, при этом большой разброс диапазона обусловлен отсутствием консенсуса по тому, что считать отдельным видом клеток, и вероятно, межвидовыми различиями[61]. По крайней мере из 16 различных типов клеток состоят почечные канальцы[62]. Сами канальцы поделены на по крайней мере 14 сегментов[62], которые различаются типами клеток и функциями[63]. Нормальное функционирование почек обеспечивается всей совокупностью эпителиальных, эндотелиальных, интерстициальных и иммунных клеток[64].
Кровоснабжение

Кровь поступает в почку через почечную артерию[28], которая в многодолевой почке затем разветвляется в области почечной лоханки на крупные междолевые артерии, проходящие по почечным столбам[32][65][32]. Междолевые артерии, в свою очередь, ветвятся у основания пирамиды, давая начало дуговым, от которых в корковое вещество отходят междольковые артерии[65]. Междолевые артерии снабжают пирамиды и прилегающее корковое вещество разветвлённой сетью кровеносных сосудов[32]. Само корковое вещество сильно пронизано артериями, в то время как в мозговом веществе артерии отсутствуют[11]. Венозный отток крови идёт обратно параллельно артериям[65]. У некоторых видов в корковом веществе под капсулой формируются сплетения из обособленных от артерий вен, которые у человека называются звёздчатыми, впадают эти вены в междольковые вены[66]. Почечно-портальная система кровообращения[англ.] у млекопитающих отсутствует[67], за исключением однопроходных[68].
Сосудистые клубочки нефронов получают кровь от афферентных артериол, которые, в свою очередь, берут начало в междольковых артериях с промежуточным формированием преартериол. От каждой афферентной артериолы отходит несколько почечных клубочков. Затем эти клубочки переходят в эфферентную артериолу, в которую от нефронов поступает отфильтрованная кровь. У нефронов с длинной петлёй Генле эфферентные артериолы разветвляются, формируя прямые сосуды[англ.] (лат. vasa recta), нисходящие в мозговое вещество. Восходящие прямые сосуды, нисходящие прямые сосуды и петля Генле в совокупности формируют противоточную систему почки. В афферентную артериолу кровь подаётся под высоким давлением, что способствует фильтрации, а в эфферентной она оказывается под низким давлением, что способствует реабсорбции[65].
Несмотря на небольшие размеры, на почки млекопитающих приходится значимая часть минутного объёма кровообращения[69]. Считается, что у сухопутных млекопитающих через почки проходит примерно пятая часть объёма крови, который проходит через сердце[70]. У взрослых мышей, например, этот показатель составляет 9 %—22 %[71].
Лимфатическая система
Почка достаточно хорошо снабжена лимфатическими сосудами[72], которые удаляют из заполняющего пространство между канальцами и кровеносными сосудами интерстиция излишнюю жидкость, растворённые в ней вещества и макромолекулы[73][74]. Анатомия лимфатический системы почки между млекопитающими схожа[75]. Лимфатические сосуды в основном повторяют путь кровеносных[76].
Начинается лимфатическая система почек в корковом веществе с начальных внутридольковых лимфатических капилляров, проходящих вблизи канальцев и почечных телец, но при этом лимфатические сосуды не заходят внутрь почечных телец. Далее внутридольковые лимфатические капилляры соединяются с дуговыми лимфатическими сосудами[77]. Дуговые переходят в междолевые, которые проходят вблизи междолевых артерий[77][75]. Дуговые и междолевые лимфатические сосуды являются лимфатическими преколлекторами[60]. Наконец, междолевые переходят в собирательные лимфатические сосуды почечных ворот, выходящие из почки[77]. В мозговом веществе лимфатические сосуды у млекопитающих обычно не присутствуют, а роль лимфатических сосудов берут на себя прямые сосуды[англ.] (лат. vasa recta)[78][79].
У отдельных видов могут быть отличия в анатомии лимфатической системы почки. Например, у овец отсутствуют лимфатические сосуды в почечной капсуле, а у кроликов отсутствуют междольковые лимфатические сосуды[77]. Что касается мозгового вещества, в большинстве исследований не удаётся обнаружить лимфатические сосуды в мозговом веществе почек животных, в частности, они не обнаружены у овец и крыс. Отдельные исследования обнаружили лимфатические сосуды в мозговом веществе почек свиней и кроликов[79]. В зависимости от вида может также быть или не быть соединение между лимфатическими сосудами почечной капсулы и почечной лимфатической системой[80].
Снабжение нервами
Иннервация почки обеспечивается входящими в почку через почечные ворота[28] эфферентными симпатическими нервными волокнами, берущими своё начало в солнечном сплетении[81][82], и афферентными, выходящими из почки к спинальному ганглию[81]. Достоверных доказательств иннервации почки парасимпатическими нервами нет[81], существующие же свидетельства являются спорными[83]. Эфферентные симпатические нервные волокна достигают сосудистой системы почки, почечных канальцев, юкстагломерулярных клеток и стенки почечной лоханки[84], при этом все части нефрона иннервируются симпатическими нервами[81]. Проходят нервные волокна внутри соединительной ткани, расположенной вокруг артерий и артериол. В мозговом веществе нисходящие прямые сосуды (лат. vasa recta) иннервируются до тех пор, пока они содержат в себе гладкомышечные клетки[85]. Большинство афферентных нервных волокон расположены в области почечной лоханки[86]. Подавляющая часть нервов в почках являются немиелинизированными[87].
Нормальная физиологическая стимуляции эфферентных симпатических нервов почки участвует в поддержании баланса воды и натрия в организме. Активация эфферентных симпатических нервов почки снижает в ней кровоток, соответственно, фильтрацию и выведение с мочой натрия, а также увеличивает скорость секреции ренина[88]. Афферентные нервы в почке также участвуют в поддержании баланса. Механочувствительные нервы почки активируются растяжением ткани почечной лоханки, что может произойти при увеличении скорости потока мочи из почки, в результате чего рефлекторно снижается активность эфферентных симпатических нервов. То есть активация афферентных нервов в почке подавляет активность эфферентных[89].
Функции
Выделительная функция
У млекопитающих азотистые продукты метаболизма выводятся преимущественно в форме мочевины[7], которая является конечным продуктом метаболизма млекопитающих[90] и хорошо растворима в воде[91]. Мочевина образуется преимущественно в печени в качестве побочного продукта метаболизма белков[92]. Большая часть мочевины выводится именно почками[90]. Фильтрация крови, как и у других позвоночных происходит в почечных клубочках, где кровь под давлением проходит через проницаемый барьер, который отфильтровывает клетки крови и большие белковые молекулы, образуя первичную мочу. Отфильтрованная первичная моча осмотически и по содержанию ионов такая же, что и плазма крови. В канальцах нефрона происходит последующее повторное всасывание полезных для организма веществ, растворённых в первичной моче, и концентрация мочи[93].
Осморегуляция
Почки млекопитающих поддерживают почти неизменный уровень осмолярности плазмы крови. Основной составляющей плазмы крови, определяющей её осмолярность являются натрий и его анионы[94]. Ключевую роль в поддержании постоянного уровня осмолярности играет контроль соотношения натрия и воды в крови[94][95]. Потребление большого количества воды способно разбавить плазму крови, в этом случае почки вырабатывают более разбавленную мочу по сравнению с плазмой, чтобы оставить соль в крови, но вывести излишки воды. Если же воды потребляется слишком мало, то моча выводится более концентрированной, чем плазма крови[94]. Концентрация мочи обеспечивается осмотическим градиентом, который увеличивается от границы между корковым и мозговым веществом до вершины мозговой пирамиды[94].
Помимо почек в регулировании баланса воды участвуют гипоталамус и нейрогипофис посредством системы обратной связи. Осморецепторы гипоталамуса реагируют на повышение осмолярности плазмы крови, в результате чего стимулируется секреция вазопрессина задней долей гипофиса, а также возникает жажда. Почки посредством рецепторов реагируют на увеличение уровня вазопрессина повышением реабсорбции воды, в результате чего осмолярность плазмы снижается за счёт её разбавления водой[96].
Варьирование количества выводимой воды является важной в плане выживания функцией для млекопитающих, у которых доступ к воде ограничен[94]. Особенностью почек млекопитающих являются петли Генле, они представляют собой наиболее эффективный способ реабсорбции воды и создания концентрированной мочи, что позволяет сохранять воду в организме[97]. После прохождения петли Генле жидкость становится гипертонической по отношению к плазме крови[98]. Почки млекопитающих сочетают в себе нефроны с короткой и с длинной петлёй Генле[99]. Способность концентрации мочи определяется главным образом структурой мозгового вещества и длиной петель Генле[100]. Некоторые животные, обитающие в пустыне, эволюционно развили способность к куда большей концентрации мочи, чем у других животных[101]. Более длинные петли у австралийских тушканчиковых мышей позволяют создавать очень концентрированную мочу[97] и выживать в условиях недостатка воды.
Эндокринная функция
Помимо выделительной, почки также выполняют эндокриную функцию, то есть вырабатывают некоторые гормоны. В юкстагломерулярных клетках почек вырабатывается ренин, являющийся ключевым регулятором ренин-ангиотензиновой системы, которая отвечает за регулирование кровяного давления[19].
Выработка эритропоэтина почками отвечает за дифференцирование клеток-предшественников эритроидного ряда в костном мозге в эритроциты и индуцируется гипоксией. Таким образом при недостатке кислорода повышается количество красных кровяных телец в крови, которые отвечают за перенос кислорода[20].
Почки участвуют в метаболизме витамина D. В печени витамин D преобразуется в кальцифедиол[англ.] (25OHD), почки же преобразуют кальцифедиол в кальцитриол (1,25(OH)2D), который является активной формой витамина и по своей сути является гормоном. Витамин D участвует в формировании костей и хрящевой ткани, а также выполняет ряд других функций, например, участвует в работе иммунной системы[21].
Регуляция кровяного давления
Некоторые внутренние органы млекопитающих, включая почки и лёгкие, рассчитаны на функционирование в пределах нормального уровня кровяного давления и нормального уровня объёма крови, а само кровяное давление также зависит от изменений уровня объёма крови. Поэтому поддержание постоянства объёма крови для млекопитающих является очень важной функцией организма[102]. На постоянство объёма крови оказывают влияние скорость клубочковой фильтрации, работа отдельный частей нефрона, симпатическая нервная система и ренин-ангиотензин-альдостероновая система[103].
В стенках афферентных артериол, у входа в почечные клубочки, расположены юкстагломерулярные клетки. Эти клетки являются чувствительными к изменению минутного объёма кровообращения, к составу и объёму внеклеточной жидкости, вырабатывая в ответ на изменения ренин[104]. Попадая в кровоток, ренин преобразует ангиотензиноген в ангиотензин I. Ангиотензин I далее расщепляется ангиотензинпревращающим ферментом до ангиотензина II, который является сильным сосудосуживающим средством, повышающим кровяное давление[104]. Помимо ангиотензина II у млекопитающих могут образовываться и другие биологически активные вещества. Ангиотензин II может расщепляться до ангиотензина III, ангеотензина IV и ангиотензина (1—7)[105].
Примечания
- ↑ 1,0 1,1 Abdalla, 2020, Abstract, p. 1.
- ↑ Philip C. Withers, Christine E. Cooper, Shane K. Maloney, Francisco Bozinovic, Ariovaldo P. Cruz Neto. Ecological and Environmental Physiology of Mammals. — Oxford University Press, 2016. — С. 39. — 867 с. — ISBN 978-0-19-109268-8.
- ↑ 3,0 3,1 Keogh, Kilroy, Bhattacharjee, 2020, 7.3. Mammals, p. 8.
- ↑ 4,0 4,1 4,2 4,3 Jo Ann Eurell, Brian L. Frappier. Dellmann's Textbook of Veterinary Histology. — John Wiley & Sons, 2013. — С. 566. — 1043 с. — ISBN 978-1-118-68582-2.
- ↑ 5,0 5,1 5,2 Withers, Cooper, Maloney, et al., 2016, 3.6.3 The Kidney, p. 250.
- ↑ Jane C. Fenelon, Caleb McElrea, Geoff Shaw, Alistair R. Evans, Michael Pyne. The Unique Penile Morphology of the Short-Beaked Echidna, Tachyglossus aculeatus // Sexual Development: Genetics, Molecular Biology, Evolution, Endocrinology, Embryology, and Pathology of Sex Determination and Differentiation. — 2021. — Т. 15, вып. 4. — С. 262–271. — ISSN 1661-5433. — doi:10.1159/000515145. — PMID 33915542.
- ↑ 7,0 7,1 Robert A. Fenton, Mark A. Knepper. Urea and renal function in the 21st century: insights from knockout mice // Journal of the American Society of Nephrology: JASN. — 2007-03. — Т. 18, вып. 3. — С. 679–688. — ISSN 1046-6673. — doi:10.1681/ASN.2006101108.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72-73.
- ↑ 9,0 9,1 9,2 9,3 9,4 Breshears, Confer, 2017, Structure, p. 617.
- ↑ 10,0 10,1 10,2 Ortiz, 2001, Kidney structure, p. 1832.
- ↑ 11,0 11,1 Kriz, Kaissling, 2012, Renal vasculature, p. 595.
- ↑ Davidson, 2009, Figure 1. Structure of the mammalian kidney.
- ↑ 13,0 13,1 Dantzler, 2016.
- ↑ Ilkka Pietilä, Seppo J. Vainio. Kidney Development: An Overview (англ.) // Nephron Experimental Nephrology. — 2014. — May (vol. 126, iss. 2). — P. 40–44. — ISSN 1660-2129. — doi:10.1159/000360659. Архивировано 26 июня 2022 года.
- ↑ Casotti, Lindberg, Braun, 2000, с. R1722-R1723.
- ↑ Шаблон:Британника
- ↑ Jing Yu, M. Todd Valerius, Mary Duah, Karl Staser, Jennifer K. Hansard. Identification of molecular compartments and genetic circuitry in the developing mammalian kidney (англ.) // Development. — 2012. — 15 May (vol. 139, iss. 10). — P. 1863–1873. — ISSN 0950-1991. — doi:10.1242/dev.074005. — PMID 22510988. Архивировано 15 июля 2022 года.
- ↑ George A. Feldhamer, Lee C. Drickamer, Stephen H. Vessey, Joseph F. Merritt, Carey Krajewski. Mammalogy: Adaptation, Diversity, Ecology. — JHU Press, 2015. — С. 198. — 764 с. — ISBN 978-1-4214-1588-8.
- ↑ 19,0 19,1 Maria L. S. Sequeira Lopez, R. Ariel Gomez. The renin phenotype: roles and regulation in the kidney (англ.) // Current Opinion in Nephrology and Hypertension. — 2010. — July (vol. 19, iss. 4). — P. 366–371. — ISSN 1473-6543. — doi:10.1097/MNH.0b013e32833aff32. — PMID 20502328. Архивировано 8 мая 2022 года.
- ↑ 20,0 20,1 Sukanya Suresh, Praveen Kumar Rajvanshi, Constance T. Noguchi. The Many Facets of Erythropoietin Physiologic and Metabolic Response (англ.) // Frontiers in Physiology. — 2020. — 17 January (vol. 10). — ISSN 1664-042X. — doi:10.3389/fphys.2019.01534/full. — PMID 32038269. Архивировано 8 мая 2022 года.
- ↑ 21,0 21,1 Daniel D. Bikle. Vitamin D: an ancient hormone: Vitamin D: an ancient hormone (англ.) // Experimental Dermatology. — 2011-01. — Vol. 20, iss. 1. — P. 7–13. — doi:10.1111/j.1600-0625.2010.01202.x.
- ↑ David H. Evans. Osmotic and Ionic Regulation: Cells and Animals. — CRC Press, 2008. — С. 506. — 615 с. — ISBN 978-0-8493-8052-5.
- ↑ Óscar Cortadellas Rodríguez, María Luisa Suárez Rey. 3D Nephrology in Small Animals. — Grupo Asís Biomedia S.L., 2021. — С. 5. — 120 с. — ISBN 978-84-17225-34-6.
- ↑ Katerina Apelt, Roel Bijkerk, Franck Lebrin, Ton J. Rabelink. Imaging the Renal Microcirculation in Cell Therapy (англ.) // Cells. — 2021. — May (vol. 10, iss. 5). — P. 1087. — ISSN 2073-4409. — doi:10.3390/cells10051087. — PMID 34063200. Архивировано 3 мая 2022 года.
- ↑ Lauralee Sherwood, Hillar Klandorf, Paul Yancey. Animal Physiology: From Genes to Organisms. — Cengage Learning, 2012. — С. 569. — 904 с. — ISBN 978-1-133-70951-0.
- ↑ Philip Carew Withers, Christine E. Cooper, Shane K. Maloney, Francisco Bozinovic, Ariovaldo P. Cruz-Neto. Ecological and Environmental Physiology of Mammals. — Oxford University Press, 2016. — С. 250. — 607 с. — ISBN 978-0-19-964271-7.
- ↑ Christopher Thigpen, Logan Best, Troy Camarata. Comparative morphology and allometry of select extant cryptodiran turtle kidneys (англ.) // Zoomorphology. — 2020. — 1 March (vol. 139, iss. 1). — P. 111–121. — ISSN 1432-234X. — doi:10.1007/s00435-019-00463-3. Архивировано 22 мая 2022 года.
- ↑ 28,0 28,1 28,2 Donald W. Linzey. Vertebrate Biology. — JHU Press, 2012. — С. 319. — 602 с. — ISBN 978-1-4214-0040-2.
- ↑ Cesare De Martino, Delmas J. Allen, Lidia Accinni. Microscopic structure of the kidney (англ.) // Basic, Clinical, and Surgical Nephrology / L. J. A. Didio, P. M. Motta. — Boston, MA: Springer US, 1985. — P. 53–82. — ISBN 978-1-4613-2575-8. — doi:10.1007/978-1-4613-2575-8_4.
- ↑ 30,0 30,1 Davidson, 2009, Figure 1 Structure of the mammalian kidney.
- ↑ D. B. Moffat. The Mammalian Kidney. — CUP Archive, 1975. — С. 16—18. — 280 с. — ISBN 978-0-521-20599-3.
- ↑ 32,0 32,1 32,2 32,3 Шаблон:Британника
- ↑ Kelley, Fenton Crosland and Ramsay, James Arthur. Excretion - Mammals (англ.). Encyclopedia Britannica (2 апреля 2020). Дата обращения: 4 июня 2022.
- ↑ Anatomy of the Kidney & Ureter. SEER Training. U. S. National Cancer Institute. Дата обращения: 29 июля 2022.
- ↑ Keith M. Dyce, Wolfgang O. Sack, C. J. G. Wensing. Textbook of Veterinary Anatomy - E-Book. — Elsevier Health Sciences, 2009. — С. 177. — 849 с. — ISBN 978-1-4377-0875-2.
- ↑ Davidson, 2009, Figure 1. Structure of the mammalian kidney, p. 2.
- ↑ Jia L. Zhuo, Xiao C. Li. Proximal nephron (англ.) // Comprehensive Physiology. — 2013. — July (vol. 3, iss. 3). — P. 1079–1123. — ISSN 2040-4603. — doi:10.1002/cphy.c110061. — PMID 23897681. Архивировано 26 июля 2022 года.
- ↑ Grant Maxie, 2015, Anatomy, p. 379.
- ↑ 39,0 39,1 Sands, Layton, 2012, Kidney Structure, с. 1464.
- ↑ 40,0 40,1 40,2 40,3 40,4 Ferdinand Rodriguez, Ferdinand Cohen, Christopher K. Ober, Lynden Archer. Toxicology of the Kidney. — CRC Press, 2004. — С. 22. — 1413 с. — ISBN 978-1-134-53651-1.
- ↑ 41,0 41,1 41,2 Kriz, Kaissling, 2012, Kidney Types and Renal Pelvis, p. 595.
- ↑ 42,0 42,1 Xin J. Zhou, Zoltan G. Laszik, Tibor Nadasdy, Vivette D. D'Agati. Silva's Diagnostic Renal Pathology (англ.). — Cambridge University Press, 2017. — P. 19. — 691 p. — ISBN 978-1-316-61398-6.
- ↑ Grant Maxie, 2015, Anatomy, p. 378.
- ↑ Davidson, 2009, Overview of kidney structure and embryonic development.
- ↑ 45,0 45,1 Charles Rouiller, Alex F. Muller. The Kidney: Morphology, Biochemistry, Physiology. — Academic Press, 2014. — С. 357. — 576 с. — ISBN 978-1-4832-7174-3.
- ↑ W. Kriz. Structure and Function of the Renal Medulla (англ.) // Paediatric Nephrology / Johannes Brodehl, Jochen H. H. Ehrich. — Berlin, Heidelberg: Springer, 1984. — P. 3–10. — ISBN 978-3-642-69863-7. — doi:10.1007/978-3-642-69863-7_1.
- ↑ 47,0 47,1 47,2 Casotti, Lindberg, Braun, 2000, p. R1722.
- ↑ Dantzler, 2016, 2.2.6 Mammals, p. 20.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72—73.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 73.
- ↑ Abdalla, 2020, 3. Results and discussion, p. 3.
- ↑ 52,0 52,1 52,2 ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72.
- ↑ Kendall S. Frazier, John Curtis Seely, Gordon C. Hard, Graham Betton, Roger Burnett. Proliferative and Nonproliferative Lesions of the Rat and Mouse Urinary System (англ.) // Toxicologic Pathology. — 2012. — June (vol. 40, iss. 4_suppl). — P. 14S–86S. — ISSN 1533-1601 0192-6233, 1533-1601. — doi:10.1177/0192623312438736. — PMID 22637735.
- ↑ NICKEL. The Viscera of the Domestic Mammals. — Springer Science & Business Media, 2013. — С. 286. — 430 с. — ISBN 978-1-4757-6814-5.
- ↑ Dantzler, 2016, 2.2.6 Mammals, p. 19—20.
- ↑ Keogh, Kilroy, Bhattacharjee, 2020, 7.3.1. Mammalian kidneys: overall morphology, p. 8.
- ↑ Melissa H. Little. Returning to kidney development to deliver synthetic kidneys (англ.) // Developmental Biology. — 2021. — June (vol. 474). — P. 22–36. — ISSN 1095-564X. — doi:10.1016/j.ydbio.2020.12.009. — PMID 33333068.
- ↑ Russell, Hong, Windsor, et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Renal Interstitium, p. 6.
- ↑ Kriz, Kaissling, 2012, Interstitium : Definition, p. 602.
- ↑ 60,0 60,1 Russell, Hong, Windsor, et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Morphology of Renal Lymph Vessels, p. 6.
- ↑ A. Schumacher, M. B. Rookmaaker, J. A. Joles, R. Kramann, T. Q. Nguyen. Defining the variety of cell types in developing and adult human kidneys by single-cell RNA sequencing (англ.) // NPJ Regenerative medicine. — 2021. — 11 August (vol. 6, iss. 1). — P. 45. — ISSN 2057-3995. — doi:10.1038/s41536-021-00156-w. — PMID 34381054. Архивировано 3 сентября 2022 года.
- ↑ 62,0 62,1 Lihe Chen, Jevin Z. Clark, Jonathan W. Nelson, Brigitte Kaissling, David H. Ellison. Renal-Tubule Epithelial Cell Nomenclature for Single-Cell RNA-Sequencing Studies (англ.) // Journal of the American Society of Nephrology: JASN. — 2019. — August (vol. 30, iss. 8). — P. 1358–1364. — ISSN 1533-3450. — doi:10.1681/ASN.2019040415. — PMID 31253652. Архивировано 3 сентября 2022 года.
- ↑ Jae Wook Lee, Chung-Lin Chou, Mark A. Knepper. Deep Sequencing in Microdissected Renal Tubules Identifies Nephron Segment-Specific Transcriptomes // Journal of the American Society of Nephrology: JASN. — 2015-11. — Т. 26, вып. 11. — С. 2669–2677. — ISSN 1533-3450. — doi:10.1681/ASN.2014111067. — PMID 25817355. Архивировано 3 сентября 2022 года.
- ↑ Balzer, Rohacs, Susztak, 2022, Introduction, p. 1.
- ↑ 65,0 65,1 65,2 65,3 Grant Maxie, 2015, Vascular supply, p. 379.
- ↑ Kriz, Kaissling, 2012, Renal vasculature, p. 596.
- ↑ Peter H. Holz. The Reptilian Renal Portal System - A Review (англ.) // Bulletin of the Association of Reptilian and Amphibian Veterinarians. — 1999. — 1 January (vol. 9, iss. 1). — P. 4–14. — ISSN 1076-3139. — doi:10.5818/1076-3139.9.1.4.
- ↑ R. L. Kotpal. Modern Text Book of Zoology: Vertebrates. — Rastogi Publications, 2010. — С. 782. — 888 с. — ISBN 978-81-7133-891-7.
- ↑ Knut Schmidt-Nielsen. Animal Physiology: Adaptation and Environment. — Cambridge University Press, 1997-06-09. — 626 с. — ISBN 978-1-107-26850-0.
- ↑ John E. Reynolds. Biology of Marine Mammals. — Smithsonian Institution, 2013. — С. 299. — 1634 с. — ISBN 978-1-58834-420-5.
- ↑ David A. D. Munro, Peter Hohenstein, Jamie A. Davies. Cycles of vascular plexus formation within the nephrogenic zone of the developing mouse kidney // Scientific Reports. — 2017-06-12. — Т. 7, вып. 1. — С. 3273. — ISSN 2045-2322. — doi:10.1038/s41598-017-03808-4. — PMID 28607473.
- ↑ Russell, Hong, Windsor, et al., 2019, Introduction, p. 1.
- ↑ Elaine L. Shelton, Hai-Chun Yang, Jianyong Zhong, Michele M. Salzman, Valentina Kon. Renal lymphatic vessel dynamics (англ.) // American Journal of Physiology. Renal Physiology. — 2020. — 1 December (vol. 319, iss. 6). — P. F1027–F1036. — ISSN 1522-1466. — doi:10.1152/ajprenal.00322.2020. — PMID 33103446. Архивировано 18 сентября 2022 года.
- ↑ Russell, Hong, Windsor, et al., 2019, Renal Lymphatic Physiology under Normal Conditions : Formation of Renal Lymph, p. 7.
- ↑ 75,0 75,1 Harald Seeger, Marco Bonani, Stephan Segerer. The role of lymphatics in renal inflammation (англ.) // Nephrology, Dialysis, Transplantation: Official Publication of the European Dialysis and Transplant Association - European Renal Association. — 2012. — July (vol. 27, iss. 7). — P. 2634–2641. — ISSN 1460-2385. — doi:10.1093/ndt/gfs140. — PMID 22622451. Архивировано 19 сентября 2022 года.
- ↑ Russell, Hong, Windsor, et al., 2019, Anatomy of Renal Lymphatics : Renal Vascular Anatomy, p. 2.
- ↑ 77,0 77,1 77,2 77,3 Russell, Hong, Windsor, et al., 2019, Comparative Renal Lymphatic Anatomy : Mammalian Renal Lymphatic Anatomy, p. 3.
- ↑ Russell, Hong, Windsor, et al., 2019, Renal Lymphatic Physiology under Normal Conditions : Interstitial Fluid and Protein Drainage in the Medulla, p. 9.
- ↑ 79,0 79,1 Russell, Hong, Windsor, et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Medullary Lymphatics, p. 5.
- ↑ Russell, Hong, Windsor, et al., 2019, Table 1. Comparison of renal lymphatic anatomy between species, p. 5.
- ↑ 81,0 81,1 81,2 81,3 Kopp, 2018, 2.2 Intrarenal Distribution of Efferent Renal Sympathetic Nerves, p. 6.
- ↑ Почки // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Yasuna Nakamura, Tsuyoshi Inoue. Neuroimmune Communication in the Kidney (англ.) // JMA journal. — 2020-07-15. — 15 July (vol. 3, iss. 3). — P. 164–174. — ISSN 2433-3298. — doi:10.31662/jmaj.2020-0024. — PMID 33150250. Архивировано 20 июля 2022 года.
- ↑ Kopp, 2011, Abstract.
- ↑ Kriz, Kaissling, 2012, Nerves, p. 610.
- ↑ Ulla C. Kopp. Neuroanatomy. — Morgan & Claypool Life Sciences, 2011.
- ↑ Ulla C. Kopp. Neuroanatomy. — Morgan & Claypool Life Sciences, 2011.
- ↑ Kopp, 2018, Introduction, p. 1.
- ↑ Kopp, 2011, 8.1. Activation of Afferent Renal Sensory Nerves by Physiological Stimuli.
- ↑ 90,0 90,1 Mark A. Knepper, Françoise Roch–Ramel. Pathways of urea transport in the mammalian kidney (англ.) // Kidney International. — 1987. — 1 February (vol. 31, iss. 2). — P. 629–633. — ISSN 0085-2538. — doi:10.1038/ki.1987.44. — PMID 3550233.
- ↑ Ramsay, James Arthur and Kelley, Fenton Crosland. excretion - General features of excretory structures and functions | Britannica (англ.). Encyclopedia Britannica (2 апреля 2020). Дата обращения: 4 июня 2022.
- ↑ Robert A. Fenton, Mark A. Knepper. Urea and renal function in the 21st century: insights from knockout mice (англ.) // Journal of the American Society of Nephrology: JASN. — 2007. — March (vol. 18, iss. 3). — P. 679–688. — ISSN 1046-6673. — doi:10.1681/ASN.2006101108. — PMID 17251384. Архивировано 22 сентября 2022 года.
- ↑ Bradley, 2009, 8.4 Terrestrial vertebrates, p. 121.
- ↑ 94,0 94,1 94,2 94,3 94,4 Sands, Layton, 2009, Introduction.
- ↑ Bernard C. Rossier. Osmoregulation during Long-Term Fasting in Lungfish and Elephant Seal: Old and New Lessons for the Nephrologist (англ.) // Nephron. — 2016. — September (vol. 134, iss. 1). — P. 5–9. — ISSN 2235-3186 1660-8151, 2235-3186. — doi:10.1159/000444307. — PMID 26901864. Архивировано 22 сентября 2022 года.
- ↑ Mark A. Knepper, Tae-Hwan Kwon, Soren Nielsen. Molecular physiology of water balance (англ.) // The New England Journal of Medicine. — 2015. — 2 April (vol. 372, iss. 14). — P. 1349–1358. — ISSN 1533-4406. — doi:10.1056/NEJMra1404726. — PMID 25830425. Архивировано 23 сентября 2022 года.
- ↑ 97,0 97,1 Schulte, Kunter, Moeller, 2014, Adapting to living on dry land: the water-retaining kidney was invented twice, p. 718.
- ↑ Chris Lote. The loop of Henle, distal tubule and collecting duct (англ.) // Principles of Renal Physiology / Chris Lote. — Dordrecht: Springer Netherlands, 2000. — P. 70–85. — ISBN 978-94-011-4086-7. — doi:10.1007/978-94-011-4086-7_6.
- ↑ Wen Liu, Tetsuji Morimoto, Yoshiaki Kondo, Kazuie Iinuma, Shinichi Uchida. “Avian-type” renal medullary tubule organization causes immaturity of urine-concentrating ability in neonates (англ.) // Kidney International. — 2001. — 1 August (vol. 60, iss. 2). — P. 680–693. — ISSN 0085-2538. — doi:10.1046/j.1523-1755.2001.060002680.x. — PMID 11473651. Архивировано 14 марта 2022 года.
- ↑ Abdalla, 2020, 1. Introduction, p. 1—2.
- ↑ William H. Dantzler. Renal Adaptations of Desert Vertebrates (англ.) // BioScience. — 1982. — February (vol. 32, iss. 2). — P. 108–113. — ISSN 0006-3568. — doi:10.2307/1308563.
- ↑ Bradley, 2009, 11.5 The mammalian kidney, p. 164.
- ↑ David Fournier, Friedrich C. Luft, Michael Bader, Detlev Ganten, Miguel A. Andrade-Navarro. Emergence and evolution of the renin-angiotensin-aldosterone system (англ.) // Journal of Molecular Medicine (Berlin, Germany). — 2012. — May (vol. 90, iss. 5). — P. 495–508. — ISSN 1432-1440. — doi:10.1007/s00109-012-0894-z. — PMID 22527880. Архивировано 27 сентября 2022 года.
- ↑ 104,0 104,1 Maria Luisa S. Sequeira-Lopez, R. Ariel Gomez. Renin Cells, the Kidney, and Hypertension (англ.) // Circulation Research. — 2021. — 2 April (vol. 128, iss. 7). — P. 887–907. — ISSN 1524-4571. — doi:10.1161/CIRCRESAHA.121.318064. — PMID 33793334. Архивировано 26 сентября 2022 года.
- ↑ Neil Hazon, F. Brian Eddy, Gert Flik. Ionic Regulation in Animals: A Tribute to Professor W.T.W.Potts. — Springer Science & Business Media, 2012. — С. 153. — 217 с. — ISBN 978-3-642-60415-7.
Литература
Книги
- Принципы и методы оценки нефротоксичности, связанной с воздействием химических веществ..
- Mouse kidney development.
- Comparative Physiology of the Vertebrate Kidney. — Springer.
- Chapter 20 - Structural Organization of the Mammalian Kidney.
- Chapter 43 - Urine Concentrating Mechanism and Urea Transporters.
- Jubb, Kennedy & Palmer's Pathology of Domestic Animals.
- Ecological and Environmental Physiology of Mammals.
- Chapter 11 - The Urinary System.
- Neural Control of Renal Function (англ.). — Morgan & Claypool Life Sciences, 2011.
- Neural Control of Renal Function, Second Edition (англ.). — Biota Publishing, 2018.
- Animal Osmoregulation.
Статьи в журналах
- The evolution of blood pressure and the rise of mankind.
- The struggle to equilibrate outer and inner milieus: Renal evolution revisited.
- Functional morphology of the avian medullary cone.
- How Many Cell Types Are in the Kidney and What Do They Do?.
- Anatomical features in the kidney involved in water conservation through urine concentration in dromedaries (Camelus dromedarius).
- Osmoregulation in marine mammals.
- Renal Lymphatics: Anatomy, Physiology, and Clinical Implications.
- The physiology of urinary concentration: an update.