Гексагидроксостаннат(IV) натрия
Внешний вид
| Гексагидроксостаннат(IV) натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гексагидроксостаннат натрия |
| Традиционные названия | Гексагидроксооловяннокислый натрий; станнат натрия |
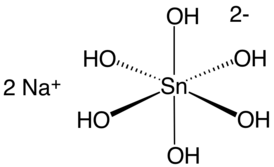
| Хим. формула | Na2[Sn(OH)6] |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 266,73 г/моль |
| Плотность | 3,05 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 61,315,5; 50100 г/100 мл |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гексагидроксостаннат(IV) натрия — неорганическое соединение, соль щелочного металла натрия и гексагидроксооловянной кислоты с формулой Na2[Sn(OH)6] (или Na2SnO3•3H2O), бесцветные кристаллы, хорошо растворимые в воде, растворимость снижается с повышением температуры.
Получение
- Кипячение в концентрированном растворе едкого натра порошка олова:
- [math]\displaystyle{ \mathsf{Sn + 2NaOH + 4H_2O \ \xrightarrow{100^oC}\ Na_2[Sn(OH)_6] + 2H_2 } }[/math]
- или оксида олова:
- [math]\displaystyle{ \mathsf{SnO_2 + 2NaOH + 2H_2O \ \xrightarrow{60-70^oC}\ Na_2[Sn(OH)_6] } }[/math]
Физические свойства
Гексагидроксостаннат(IV) натрия выделяется из раствора в виде бесцветных кристаллов, ромбоэдрической сингонии, пространственная группа R 3, параметры ячейки a = 0,595 нм, c = 1,417 нм, Z = 3. Устойчивый на воздухе, растворимый в воде.
Химические свойства
- При нагревании разлагается:
- [math]\displaystyle{ \mathsf{Na_2[Sn(OH)_6] \ \xrightarrow{140^oC}\ Na_2SnO_3 + 3H_2O } }[/math]
- [math]\displaystyle{ \mathsf{Na_2[Sn(OH)_6] \ \xrightarrow{900^oC}\ Na_2O + SnO_2 + 3H_2O } }[/math]
- Реагирует с разбавленными кислотами:
- [math]\displaystyle{ \mathsf{Na_2[Sn(OH)_6] + 2HCl \ \xrightarrow{}\ SnO_2\downarrow + 2NaCl + 4H_2O } }[/math]
- Реагирует с углекислым газом:
- [math]\displaystyle{ \mathsf{Na_2[Sn(OH)_6] + CO_2 \ \xrightarrow{}\ SnO_2\downarrow + Na_2CO_3 + 3H_2O } }[/math]
- Вступает в обменные реакции:
- [math]\displaystyle{ \mathsf{Na_2[Sn(OH)_6] + Ca(NO_3)_2 \ \xrightarrow{}\ Ca[Sn(OH)_6]\downarrow + 2NaNO_3 } }[/math]
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.