Бороводороды
Бо̀роводоро́ды (также бора́ны, гидри́ды бо́ра[1]) — химические соединения бора с водородом. Отличаются высокой химической активностью и чрезвычайно большой теплотой сгорания. Представляют интерес как ракетное топливо. В органическом синтезе находит применение реакция присоединения борана и некоторых алкилборанов к двойной связи алкенов с вовлечением полученных соединений в дальнейшие превращения.
Представляют собой бесцветные и неустойчивые молекулярные соединения. Бораны обладают высокой реакционной способностью.
Известны бораны с числом атомов бора от 2 до 20. В свободном виде BH3 нестабилен, но известен в виде некоторых комплексных соединений[1].
Получение бороводородов
Бороводороды являются недостаточно устойчивыми термодинамически соединениями бора и водорода и в связи с этим синтезируются обычно косвенными методами.
На сегодняшний день одним из основных способов получения бороводородов является так называемый «магниевый метод» или «Способ Стока», то есть получение борида магния и последующее разложение последнего соляной кислотой. Полученные бораны (бороводороды) подвергают вакуумной разгонке, очистке и накапливают разделённые отдельные бороводороды в соответствующих условиях для сохранения и дальнейшего использования.
Другим важным промышленным способом получения бороводородов является способ, предложенный впервые Шлезингером и Бургом. Способ заключается в реакции трёххлористого бора с водородом в вольтовой дуге высокого напряжения. Полученный в нём гидрохлороборан подвергают диспропорционированию при охлаждении до комнатной температуры, после чего разделяют диборан и трёххлористый бор. Выход диборана приближается к 55 % вес. В дальнейшем Шлезингер и Браун предложили новый способ эффективного получения бороводородов путём реакции обмена между тетрагидридоборатом натрия (Na[BH4]) и трёхфтористым бором. Для получения диборана можно воздействовать на галогениды бора гидридом натрия при нагревании до 175°С или алюмогидридом лития в эфирном растворе:
- [math]\displaystyle{ \mathsf{2BF_3 + 6NaH \rightarrow B_2H_6\uparrow + 6NaF} }[/math]
- [math]\displaystyle{ \mathsf{4BCl_3 + 3LiAlH_4 \rightarrow 2B_2H_6\uparrow + 3LiCl\downarrow + 3AlCl_3\downarrow} }[/math]
Все высшие бораны получают исключительно путём термического крекинга диборана.
Классификация
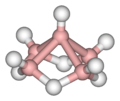
Бораны могут быть разделены на несколько типов по строению и составу. Клозо-бораны описываются формулой [BnHn]2-, где n = 6-12. Они представляют собой анионные кластеры, то есть имеют заряд. Нейтральные клозо-бораны пока не получены. К нидо-боранам относятся B5H9, B10H14, а также анионные полиэдры состава BnHn+4, к которым относится и диборан B2H6. Бораны, представляющие собой полиэдры с двумя свободными вершинами, называются арахно-боранами. Они описываются формулой BnHn+6, например, B4H10, B5H11 и B8H14. Выделена также группа боранов, в которых число свободных вершин равно 3, они получили название гифо-бораны. Их формула BnHn+8, например, B8H16 или B10H18. Существуют также бораны со сложным строением, сочетающим фрагменты указанных выше типов боранов. Их называют конжукто-боранами.
Строение
В молекуле диборана B2H6 отсутствует химическая связь между атомами бора. Она не может образоваться, поскольку в этом случае объединялись бы орбитали бора, не имеющие электронов. Поэтому объединяться должны те орбитали, на которых есть электроны, а именно орбитали, участвующие в образовании связи B-H во фрагментах BH3. В итоге в молекуле B2H6 три атома B-H-B связаны одной парой электронов, такая химическая связь получила название двухэлектронной трехцентровой. Она слабее стандартной двухэлектронной двухцентровой, какая наблюдается, например, в алканах, однако в диборане их две, что обеспечивает прочность молекулы. Таким образом, два атома бора в диборане связаны двумя мостиковыми атомами водорода.
Свойства бороводородов
| Формула | Температура плавления, °С | Температура кипения, °С | Плотность, г/см³ | Теплота обр.,298,15 К, ккал/моль | Термостабильность | Реакция с воздухом | Реакция с Н2О |
|---|---|---|---|---|---|---|---|
| В2Н6 | −165,5 °C | −92,5 °C | тв.0,577−183, ж.0,447−112 | +9,8(газ) | Стаб. при 25 °C | Самовоспл. | Мгновенно гидролизуется |
| В4Н10 | −120,0 °C | +18 °C | ж.0,56−36 | +7,53(газ) | Разл. при 25 °C | Самовоспл. в прис. воды | Гидролизуется 24 ч |
| В5Н9 | −46,81 °C | +62 °C | ж.0,610 | +10,240(жидк) +17,5(газ) | Стаб. при 25 °C | Самовоспл. | Гидролизуется при нагревании |
| В5Н11 | −123 °C | +63 °C | +22,2(газ) | Медл. разл. при 150 °C | Самовоспл. | Гидролизуется быстро | |
| В6Н10 | −62,3 °C | +110 °C | ж.0,69о | +19,6(газ) | Разл. при 25 °C | Стабилен | Гидролизуется при нагревании |
| В6Н12 | −90 °C | Разл. при 25 °C | Стабилен | Гидролизуется при нагревании | |||
| В9Н15 | +2,6 °C | Разл. при 25 °C | Стабилен | Гидролизуется при нагревании | |||
| В10Н14 | +98,78 °C | +219 °C | тв.0,9425, ж.0,78100 | −6,9(тв.) −1,7(ж.) +11,3(газ.) | Стаб. при 150 °C | Очень стабилен | Медленно гидролизуется |
Бороорганические соединения в качестве ракетного топлива
Наиболее удобен для синтеза и применения пентаборан(9) (B5H9). Остальные бороводороды интенсивно изучаются, но их применение в настоящее время ограничено. Видами топлива, производными от бора, являются пропилпентаборан (US: BEF-2) и этилпентаборан (US: BEF-3)[2]. Диборан, декаборан и их производные также исследовались на предмет перспективности использования.
Применение в топливных элементах
Возможно применение борогидридов NaBH4 и KBH4 в топливных элементах. Это дает несколько преимуществ[3]:
- Приемлемая скорость процесса;
- Возможность протекания процесса при низкой и отрицательной температуре;
- Используемые растворы борогидридов негорючи и стабильны, что достигается подщелачиванием;
- Образование нетоксичных продуктов H2O и NaBO2 (KBO2);
- Борат может быть регенерирован (переработан в борогидрид);
- Образование водорода высокой чистоты;
- Контролируемая подбором катализаторов скорость реакции.
Однако несмотря на все эти преимущества, топливные элементы на основе борогидридов пока не получили широкого распространения. Причина состоит в высокой стоимости производимой электроэнергии, которая суммируется из стоимости каталитических систем (дорогостоящие Pt-содержащие катализаторы), ионообменных мембран и самого боргидридного топлива.
Токсичность и огнеопасность
Бороводороды — чрезвычайно ядовитые вещества, имеющие помимо общетоксической составляющей также особое, но довольно сильно выраженное нервнопаралитическое воздействие на человека и животных. Диборан обладает удушающим действием, подобно фосгену. Пентабораны и декабораны действуют на центральную нервную систему, почки и печень. Предельно допустимая концентрация в воздухе (США): диборан — 0,1 мг/м3; пентаборан(9) и пентаборан(11) — 0,01 мг/м3; декаборан(16) — 0,03 мг/м3.
Как огнеопасные вещества, бороводороды представляют собой в основном вещества с наивысшей категорией огнеопасности: они способны к самовоспламенению не только на воздухе, но и при контактах с водой и рядом галогенопроизводных углеводородов. При горении их на воздухе развиваются высокие температуры.
См. также
Примечания
- ↑ 1,0 1,1 Бороводороды — статья из Большой советской энциклопедии.
- ↑ McDonald G. Thermal stability of a commercial propyl pentaborane (BEF-2) in the range 147—190 °C (PDF). National Advisory Committee for Aeronautics (USA) (13.11.1957). Дата обращения: 9 мая 2009. Архивировано 5 февраля 2010 года.
- ↑ Основы водородной энергетики / Под ред. В. А. Мошникова и Е. И. Терукова. — СПб.: Изд-во СПбГЭТУ «Лэти», 2010. — 288 с. — ISBN 978-5-7629-1096-5.
Литература
- Кузнецов Н. Т. Бороводороды // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 306—307. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
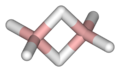

![Додекаборат[англ.]](https://cdn.xn--h1ajim.xn--p1ai/thumb.php?f=Dodecaborane-3D-balls.png&width=115)