Атомная теория

Атомная теория — это научная теория, согласно которой материя состоит из частиц, называемых атомами. Теория атома берёт свое начало в древней философской традиции, известной как атомизм. Согласно этой идее, если взять кусок материи и разрезать его на все более мелкие части, он в конечном итоге достигнет точки, когда части нельзя будет разрезать на что-либо меньшее. Древнегреческие философы называли эти гипотетические конечные частицы материи атомосом, что означало «неразрезаемый».
В начале 1800-х годов учёный Джон Дальтон заметил, что химические вещества, казалось, объединяются и распадаются на другие вещества по весу. Некоторые предполагали, что каждый химический элемент в конечном итоге состоит из крошечных неделимых частиц постоянного веса. Вскоре после 1850 года некоторые физики разработали кинетическую теорию газов и тепла, которая математически описывала поведение газов, предполагая, что они состоят из частиц. В начале 20 века Альберт Эйнштейн и Жан Перрен доказали, что броуновское движение (беспорядочное движение зёрен пыльцы в воде) вызвано действием молекул воды; эта третья линия доказательств заглушила оставшиеся у ученых сомнения в том, существуют ли атомы и молекулы в реальности. На протяжении девятнадцатого века некоторые учёные предупреждали, что доказательства существования атомов являются косвенными, и поэтому атомы на самом деле могут не быть реальными, а только казаться реальными.
К началу 20 века учёные разработали довольно подробные и точные модели структуры материи, что привело к более строгой классификации крошечных невидимых частиц, составляющих обычную материю. Атом теперь определяется как основная частица, составляющая химический элемент. Примерно на рубеже 20-го века физики обнаружили, что частицы, которые химики назвали «атомами», на самом деле являются скоплениями ещё более мелких частиц (субатомных частиц). Сейчас термин элементарная частица используется для обозначения фактически неделимых частиц, а атомы остаются самыми мелкими частицами, неделимыми химически.
История
Философский атомизм
Идея о том, что материя состоит из отдельных единиц, — очень стара. Она появилась во многих древних культурах, таких как Греция и Индия. Слово «атом» др.-греч. ἄτομος, что означает «неразрезаемый», был придуман досократическим греческим философом Левкиппом и его учеником Демокритом (460—370 до н. э.)[1][2][3][4]. Демокрит учил, что количество атомов бесконечно, они не сотворены и вечны, а качества объекта зависят от типов, составляющих его атомов. Атомизм Демокрита был усовершенствован и развит более поздним греческим философом Эпикуром (341—270 до н. э.) и римским эпикурейским поэтом Лукрецием (99-55 до н. э.). В период раннего средневековья в Западной Европе об атомизме почти забыли. В XII веке он снова стал известен в Западной Европе благодаря ссылкам на него в недавно открытых трудах Аристотеля.
В XIV веке повторное открытие основных работ, описывающих атомистические учения, в том числе De rerum natura Лукреция и О жизни, учениях и изречениях знаменитых философов Диогена Лаэртского, привело к усилению внимания учёных к этой теме. Тем не менее, поскольку атомизм был связан с философией эпикурейства, которая противоречила ортодоксальным христианским учениям, вера в атомы не считалась приемлемой для большинства европейских философов[3]. Французский католический священник Пьер Гассенди (1592—1655) возродил эпикурейский атомизм с модификациями, утверждая, что атомы были созданы Богом и, хотя их очень много, но не бесконечны. Он был первым, кто использовал термин «молекула» для описания агрегации атомов[4]. Модифицированная теория атомов Гассенди была популяризирована во Франции врачом Франсуа Бернье (1620—1688) и в Англии натурфилософом Уолтером Чарлтоном (1619—1707). Химик Роберт Бойль (1627—1691) и физик Исаак Ньютон (1642—1727) защищали атомизм, и к концу 17 века он стал принят частью научного сообщества.
Джон Дальтон
Ближе к концу 18 века появились два закона о химических реакциях, не относящиеся к понятию атомной теории. Первым был закон сохранения массы, тесно связанный с работами Антуана Лавуазье, который гласит, что общая масса в химической реакции остаётся постоянной (то есть реагенты имеют ту же массу, что и продукты)[5]. Второй — закон постоянства состава. Этот закон, впервые установленный французским химиком Жозефом Прустом в 1797 году, гласит, что если соединение разбито на составляющие его химические элементы, то массы составляющих частей всегда будут иметь одинаковые весовые пропорции, независимо от количества или источника исходного материала[6].
Джон Дальтон изучил и расширил эту предыдущую работу и защитил новую идею, позже известную как закон кратных отношений: если одни и те же два элемента могут быть объединены, чтобы образовать ряд различных соединений, то соотношение масс двух элементов в их различных соединениях будут представлены небольшими целыми числами. Это обычная картина в химических реакциях, которую наблюдали Дальтон и другие химики того времени.
Пример 1 — оксиды олова: Дальтон идентифицировал два оксида олова. Один из них представляет собой серый порошок, в котором на каждые 100 частей олова приходится 13,5 частей кислорода. Другой оксид представляет собой белый порошок, в котором на каждые 100 частей олова приходится 27 частей кислорода[7]. 13,5 и 27 образуют соотношение 1:2. Эти оксиды сегодня известны как оксид олова (II) (SnO) и оксид олова (IV) (SnO2) соответственно.
Пример 2 — оксиды железа: Дальтон идентифицировал два оксида железа. Один из них — чёрный порошок, в котором на каждые 100 частей железа приходится около 28 частей кислорода. Другой — красный порошок, в котором на каждые 100 частей железа приходится 42 части кислорода[8], 28 и 42 образуют соотношение 2:3. Эти оксиды сегодня известны как оксид железа (II) (более известный как вюстит) и оксид железа (III) (основной компонент ржавчины). Их формулы — FeO и Fe2O3 соответственно.
Пример 3 — оксиды азота: есть три оксида азота, в которых на каждые 140 г азота, содержится 80 г, 160 г, и 320 г кислорода соответственно, что дает соотношение 1:2:4. Это закись азота (N2O), оксид азота (NO) и диоксид азота (NO2) соответственно.
Этот повторяющийся шаблон предполагает, что химические вещества вступают в реакцию не в произвольном количестве, а в количестве, кратном некоторой базовой неделимой единице массы.
В своих трудах Дальтон использовал термин «атом» для обозначения основной частицы любого химического вещества, а не строго для элементов, как это принято сегодня. Дальтон не использовал слово «молекула»; вместо этого он использовал термины «составной атом» и «элементарный атом»[9]. Дальтон предположил, что каждый химический элемент состоит из атомов одного уникального типа, и, хотя они не могут быть изменены или разрушены химическими средствами, они могут объединяться в более сложные структуры с образованием химических соединений. Это ознаменовало собой первую по-настоящему научную теорию атома, поскольку Дальтон пришёл к своим выводам путём экспериментов и изучения результатов эмпирическим путем.
В 1803 году Дальтон сослался на список относительных атомных масс для ряда веществ в своём выступлении перед Манчестерским литературно-философским обществом о растворимости различных газов, таких как диоксид углерода и азота, в воде. Дальтон не указал, как он получил относительные веса, но первоначально предположил, что изменение растворимости было связано с различиями в массе и сложности частиц газа — идея, от которой он отказался к тому времени, когда статья была наконец опубликована в 1805 году[10]. На протяжении многих лет несколько историков связывали развитие атомной теории Дальтона с его изучением газовой растворимости, но недавнее исследование записей его лабораторной записной книжки показывает, что он разработал химическую атомную теорию в 1803 году, чтобы согласовать аналитические данные Кавендиша и Лавуазье о составе азотной кислоты, а не для объяснения растворимость газов в воде[11].
Томас Томсон опубликовал первое краткое изложение теории атома Дальтона в третьем издании своей книги «Система химии»[12]. В 1808 году Дальтон опубликовал более полный отчёт в первой части «Новой системы химической философии»[13]. Однако только в 1811 году Дальтон обосновал свою теорию множественных пропорций[14].
Дальтон оценил атомные веса в соответствии с массовыми отношениями, в которых они складывались, с атомом водорода, принятым за единицу. Однако Дальтон не предполагал, что некоторые элементы представляют собой атомы в молекулах — например, чистый кислород существует в виде O2. Он также ошибочно полагал, что простейшим соединением между любыми двумя элементами всегда является состояние с одним атомом каждого элемента (поэтому он думал, что вода — это HO, а не H2O)[15]. Это, в дополнение к неточности его оборудования, испортило его результаты. Например, в 1803 году он считал, что атомы кислорода в 5,5 раз тяжелее атомов водорода, поскольку в воде он измерял 5,5 граммов кислорода на каждые 1 грамм водорода и считал, что формула воды — HO. Получив более точные данные, в 1806 году он пришел к выводу, что атомный вес кислорода должен быть на самом деле 7, а не 5,5, и он сохранил этот вес на всю оставшуюся жизнь. Другие учёные в то время уже пришли к выводу, что атом кислорода должен весить 8 по отношению к водороду, равному 1, если принять формулу Дальтона для молекулы воды (HO), или 16, если принять современную формулу воды (H2O)[16].
Авогадро
Недостаток теории Дальтона был исправлен в 1811 году Амедео Авогадро. Авогадро предположил, что равные объёмы любых двух газов при одинаковой температуре и давлении содержат равное количество молекул (другими словами, масса частиц газа не влияет на объём, который он занимает)[17]. Закон Авогадро позволил ему установить двухатомную природу многих газов, изучая объёмы, при которых они реагировали. Например: поскольку два литра водорода вступают в реакцию всего с одним литром кислорода с образованием двух литров водяного пара (при постоянном давлении и температуре), это означает, что одна молекула кислорода разделяется на две части, чтобы образовать две частицы воды. Таким образом, Авогадро смог предложить более точные оценки атомной массы кислорода и различных других элементов и провести чёткое различие между молекулами и атомами.
Броуновское движение
В 1827 году британский ботаник Роберт Броун заметил, что частицы пыли внутри зёрен пыльцы, плавающих в воде, постоянно колеблются без видимой причины. В 1905 году Альберт Эйнштейн предположил, что это броуновское движение было вызвано молекулами воды, непрерывно толкающими частицы, и разработал гипотетическую математическую модель для его описания[18]. Эта модель была экспериментально подтверждена в 1908 году французским физиком Жаном Перреном, что обеспечило дополнительное подтверждение теории частиц (и, соответственно, теории атома).
Открытие субатомных частиц
Атомы считались наименьшим структурным элементом материи до 1897 года, когда Дж. Дж. Томсон открыл электрон в своей работе над катодными лучами[19].
Трубка Крукса — это герметичный стеклянный контейнер, в котором два электрода разделены вакуумным промежутком. Когда на электроды подаётся напряжение, генерируются катодные лучи, создавая светящееся пятно там, где они попадают в стекло на противоположном конце трубки. Путём экспериментов Томсон обнаружил, что лучи могут отклоняться электрическим полем (в дополнение к уже известным магнитным полям). Он пришёл к выводу, что эти лучи не являются формой света, а состоят из очень лёгких отрицательно заряженных частиц, которые он назвал «корпускулами» (позже другие учёные переименовали их в электроны). Он измерил отношение массы к заряду и обнаружил, что оно в 1800 раз меньше, чем у водорода, самого маленького атома. Эти корпускулы были частицами, не похожими ни на какие другие известные ранее.
Томсон предположил, что атомы делимы и что корпускулы были их строительными блоками[20]. Чтобы объяснить общий нейтральный заряд атома, он предположил, что корпускулы были распределены в однородном море положительного заряда; это была модель сливового пудинга[21] поскольку электроны были погружены в положительный заряд, как изюм в сливовом пудинге (хотя в модели Томсона они не были стационарными).
Открытие ядра атома
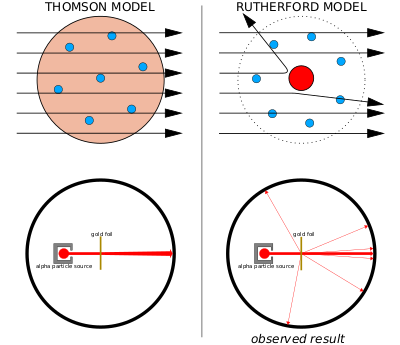
Слева: Ожидаемые результаты: альфа-частицы проходят через модель атома с пренебрежимо малым отклонением.
Справа: наблюдаемые результаты: небольшая часть частиц отклоняется концентрированным положительным зарядом ядра.
Модель сливового пудинга Томсона была опровергнута в 1909 году одним из его бывших учеников, Эрнестом Резерфордом, который обнаружил, что большая часть массы и положительного заряда атома сосредоточена в очень небольшой части его объёма, который, как он предполагал, находится в центре.
Эрнест Резерфорд и его коллеги Ханс Гейгер и Эрнест Марсден усомнились в модели Томсона после того, как столкнулись с трудностями при попытке создать прибор для измерения отношения заряда к массе альфа-частиц (это положительно заряженные частицы, испускаемые некоторыми радиоактивными веществами, например, радием). Альфа-частицы рассеивались воздухом в камере детектора, что делало измерения ненадёжными. Томсон столкнулся с подобной проблемой в своей работе над катодными лучами, которую он решил, создав почти идеальный вакуум в своих инструментах. Резерфорд не думал, что столкнется с той же проблемой, потому что альфа-частицы намного тяжелее электронов. Согласно модели атома Томсона, положительный заряд в атоме недостаточно сконцентрирован для создания электрического поля, достаточно сильного, чтобы отклонить альфа-частицу, а электроны настолько лёгкие, что их должны легко отталкивать гораздо более тяжёлые альфа-частицы. Однако рассеяние было, поэтому Резерфорд и его коллеги решили тщательно исследовать это явление[22].
Между 1908 и 1913 годами Резерфорд и его коллеги провели серию экспериментов, в которых они бомбардировали тонкие металлические фольги альфа-частицами. Они заметили альфа-частицы, отклоняющиеся на угол более 90°. Чтобы объяснить это наблюдение, Резерфорд предположил, что положительный заряд атома не распределяется по всему объёму атома, как полагал Томсон, а сосредоточен в крошечном ядре в центре. Только такая интенсивная концентрация заряда может создать электрическое поле, достаточно сильное, чтобы отклонить альфа-частицы, как это наблюдается в эксперимента[22].
Первые шаги к квантовой физической модели атома
Планетарная модель атома имела два существенных недостатка. Во-первых, в отличие от планет, вращающихся вокруг Солнца, электроны являются заряженными частицами. Ускоряющий электрический заряд, как известно, излучает электромагнитные волны в соответствии с формулой Лармора в классической электродинамике. Орбитальный заряд должен постоянно терять энергию и двигаться по спирали к ядру, сталкиваясь с ним за малую долю секунды. Вторая проблема заключалась в том, что планетарная модель не могла объяснить наблюдаемые спектры излучения и поглощения атомов с высокими пиками.

Квантовая теория произвела революцию в физике в начале 20 века, когда Макс Планк и Альберт Эйнштейн постулировали, что световая энергия излучается или поглощается в дискретных количествах, известных как кванты. В 1913 году Нильс Бор включил эту идею в свою модель атома Бора, в которой электрон мог вращаться вокруг ядра только по определённым круговым орбитам с фиксированными угловым моментом и энергией, причём его расстояние от ядра (то есть их радиусы) было пропорционально его энергии[23]. В соответствии с этой моделью электрон не может двигаться по спирали и упасть на ядро, потому что он не может непрерывно терять энергию; вместо этого он мог совершать только мгновенные «квантовые скачки» между фиксированными уровнями энергии. Когда это происходило, свет излучался или поглощался с частотой, пропорциональной изменению энергии (отсюда дискретные спектры поглощение и испускания).
Модель Бора не была идеальной. Она могла только предсказывать спектральные линии водорода; она не могла предсказать таковые для многоэлектронных атомов. Что ещё хуже, по мере совершенствования спектрографической технологии наблюдались дополнительные спектральные линии в водороде, которые модель Бора не могла объяснить. В 1916 году Арнольд Зоммерфельд добавил эллиптические орбиты к модели Бора, чтобы объяснить дополнительные эмиссионные линии, но это сделало модель очень сложной в использовании, и она всё ещё не могла объяснить более сложные атомы.
Открытие изотопов
Экспериментируя с продуктами радиоактивного распада, в 1913 году радиохимик Фредерик Содди обнаружил, что, по-видимому, в каждой ячейке периодической таблицы содержится более одного элемента[24]. Термин изотоп был придуман Маргарет Тодд как подходящее название для этих элементов.
В том же году Дж. Дж. Томсон провёл эксперимент, в котором направил поток ионов неона через магнитное и электрическое поля, на фотопластинку. Он заметил два светящихся пятна на пластине, которые предполагали две разные траектории отклонения. Томсон пришёл к выводу, что это произошло потому, что некоторые ионы неона имели другую массу[25]. Природа этой различающейся массы позже будет объяснена с открытием нейтронов в 1932 году.
Открытие ядерных частиц
В 1917 году Резерфорд бомбардировал азот альфа-частицами и наблюдал, как из газа испускаются ядра водорода (Резерфорд распознал их, потому что он ранее получил их, бомбардируя водород альфа-частицами и наблюдая ядра водорода в продуктах). Резерфорд пришёл к выводу, что ядра водорода возникли из ядер самих атомов азота (фактически, он расщепил азот)[26].
Из своей собственной работы и работ своих учеников Бора и Генри Мозли Резерфорд знал, что положительный заряд любого атома всегда можно приравнять к заряду целого числа ядер водорода. Это, вкупе с атомной массой многих элементов, примерно эквивалентной целому числу атомов водорода, которые тогда считались легчайшими частицами, привело его к выводу, что ядра водорода были единичными частицами и основной составляющей всех атомных ядер. Он назвал такие частицы протонами. Дальнейшие эксперименты Резерфорда показали, что ядерная масса большинства атомов превышает массу протонов, которыми они обладают; он предположил, что эта избыточная масса состоит из ранее неизвестных нейтрально заряженных частиц, которые предварительно назвали «нейтронами».
В 1928 году Уолтер Боте заметил, что бериллий испускает электрически нейтральное излучение с большой проникающей способностью при бомбардировке альфа-частицами. Позже было обнаружено, что это излучение может выбивать атомы водорода из парафина. Первоначально считалось, что это гамма-излучение высокой энергии, поскольку гамма-излучение оказывает аналогичное влияние на электроны в металлах, но Джеймс Чедвик обнаружил, что эффект ионизации был слишком сильным, чтобы он мог быть вызван электромагнитным излучением, при условии, что энергия и импульс сохранялись во взаимодействии. В 1932 году Чедвик подвергал различные элементы, такие как водород и азот, загадочному «излучению бериллия», и, измеряя энергии обратно рассеянных заряженных частиц, он пришел к выводу, что это излучение на самом деле состоит из электрически нейтральных частиц, которые не могут быть безмассовыми как гамма-лучи, но вместо этого обладают массой, аналогичную массе протона. Чедвик теперь объявил эти частицы нейтронами Резерфорда[27]. За открытие нейтрона Чедвик получил Нобелевскую премию в 1935 году.
Квантовые физические модели атома

В 1924 году Луи де Бройль предположил, что все движущиеся частицы — особенно субатомные частицы, такие как электроны, — демонстрируют определённое волнообразное поведение. Эрвин Шрёдингер, очарованный этой идеей, исследовал, можно ли лучше объяснить движение электрона в атоме как волну, а не как частицу. Уравнение Шрёдингера, опубликованное в 1926 году[28], описывает электрон как волновую функцию, а не как точечную частицу. Этот подход элегантно предсказал многие спектральные явления, которые модель Бора не смогла объяснить. Хотя эта концепция была удобна с математической точки зрения, её трудно было визуализировать, и она столкнулась с противодействием[29]. Один из его критиков, Макс Борн, предложил вместо этого, чтобы волновая функция Шредингера описывала не электрон, а все его возможные состояния, и, таким образом, могла использоваться для расчёта вероятности нахождения электрона в любом заданном месте вокруг ядра[30]. Это примирило две противоположные теории частиц и волновых электронов, и была введена идея дуальности волна-частица. Эта теория утверждала, что электрон может проявлять свойства как волны, так и частицы. Например, он может преломляться, как волна, и обладать массой, как частица[31].
Следствием волнового описания электронов является то, что математически невозможно одновременно определить положение и импульс электрона. Он стал известен как принцип неопределенности Гейзенберга в честь физика-теоретика Вернера Гейзенберга, который впервые описал его и опубликовал в 1927 году[32]. Это опровергло модель Бора с её аккуратными, чётко очерченными круговыми орбитами. Современная модель атома описывает положение электронов в атоме с точки зрения вероятностей. Электрон потенциально может быть найден на любом расстоянии от ядра, но, в зависимости от его уровня энергии, в одних областях вокруг ядра он существует чаще, чем в других; эта область называется его атомной орбиталью. Орбитали бывают разных форм — сфера, гантель, тор и так далее — с ядром в середине[33].
Теория строения атома в культуре

- Достаточно известно высказывание Р. Фейнмана:
Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными, и к грядущим поколениям живых существ перешла бы только одна фраза, то, какое утверждение, составленное из наименьшего числа слов, принесло бы наибольшую информацию?
Я считаю, что это атомная гипотеза: все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольших расстояниях, но отталкиваются, если одно из них плотнее прижать к другому.
В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения.Р. Фейнман.
- Модель атома в упрощённом виде является одним из известных символов науки.
- Изображение упрощённой модели Бора-Резерфорда в качестве символа атома довольно прочно вошло в муниципальную геральдику и нередко используется в гербах начиная с XX века.
Примечания
- ↑ Pullman, Bernard. The Atom in the History of Human Thought. — Oxford, England : Oxford University Press, 1998. — P. 31–33. — ISBN 978-0-19-515040-7. Архивная копия от 5 февраля 2021 на Wayback Machine
- ↑ Kenny, Anthony. Ancient Philosophy. — Oxford, England : Oxford University Press, 2004. — Vol. 1. — P. 26–28. — ISBN 0-19-875273-3. Архивная копия от 29 октября 2021 на Wayback Machine
- ↑ Перейти обратно: 3,0 3,1 Pyle, Andrew. Atoms and Atomism // The Classical Tradition. — Cambridge, Massachusetts and London, England : The Belknap Press of Harvard University Press, 2010. — P. 103–104. — ISBN 978-0-674-03572-0. Архивная копия от 29 октября 2021 на Wayback Machine
- ↑ Перейти обратно: 4,0 4,1 Handbook of Categorization in Cognitive Science. — Second. — Amsterdam, The Netherlands : Elsevier, 2017. — P. 427. — ISBN 978-0-08-101107-2. Архивная копия от 5 февраля 2021 на Wayback Machine
- ↑ Weisstein, Eric W. Lavoisier, Antoine (1743-1794). scienceworld.wolfram.com. Дата обращения: 1 августа 2009. Архивировано 7 апреля 2013 года.
- ↑ Law of definite proportions | chemistry (англ.). Encyclopedia Britannica. Дата обращения: 3 сентября 2020. Архивировано 3 ноября 2020 года.
- ↑ Dalton, 1808, p. 36.
- ↑ Dalton, 1808, p. 28.
- ↑ Dalton, 1808, p. 281.
- ↑ Dalton, John. «On the Absorption of Gases by Water and Other Liquids Архивная копия от 4 июня 2016 на Wayback Machine», in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- ↑ Grossman (2021-01-02). «John Dalton’s "Aha" Moment: the Origin of the Chemical Atomic Theory». Ambix 68 (1): 49–71. doi:10.1080/00026980.2020.1868861. ISSN 0002-6980. PMID 33577439.
- ↑ Thomas Thomson on Dalton's Atomic Hypothesis. www.chemteam.info. Дата обращения: 20 февраля 2021. Архивировано 12 февраля 2020 года.
- ↑ Dalton, 1808, p. 211–216.
- ↑ Nicholson, William. A Journal of Natural Philosophy, Chemistry and the Arts : [англ.]. — G. G. and J. Robinson, 1811. — P. 143–151.
- ↑ Johnson, Chris. Avogadro - his contribution to chemistry. Архивировано 10 июля 2002 года. Дата обращения 1 августа 2009.
- ↑ Alan J. Rocke. Chemical Atomism in the Nineteenth Century. — Columbus : Ohio State University Press, 1984.
- ↑ Avogadro, Amedeo (1811). «Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds». Journal de Physique 73: 58–76.
- ↑ Einstein (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen». Annalen der Physik 322 (8): 549–560. doi:10.1002/andp.19053220806. .
- ↑ Thomson, J. J. (1897). «Cathode rays» ([facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]). Philosophical Magazine 44 (269). doi:10.1080/14786449708621070.
- ↑ Whittaker, E. T. (1951), A History of the Theories of Aether and Electricity. Vol 1, Nelson, London
- ↑ Thomson, J. J. (1904). «On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure». Philosophical Magazine 7 (39). doi:10.1080/14786440409463107.
- ↑ Перейти обратно: 22,0 22,1 Heilbron, 2003, pp. 64—68.
- ↑ Bohr, Niels (1913). «On the constitution of atoms and molecules». Philosophical Magazine 26 (153): 476–502. doi:10.1080/14786441308634993. .
- ↑ Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation. Дата обращения: 18 января 2008. Архивировано 13 июня 2017 года.
- ↑ Thomson, J. J. (1913). «Rays of positive electricity». Proceedings of the Royal Society A 89 (607): 1–20. doi:10.1098/rspa.1913.0057. . [as excerpted in Henry A. Boorse & Lloyd Motz, The World of the Atom, Vol. 1 (New York: Basic Books, 1966)]. Retrieved on August 29, 2007.
- ↑ Rutherford, Ernest (1919). «Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen». Philosophical Magazine 37 (222). doi:10.1080/14786440608635919.
- ↑ Chadwick, James (1932). «Possible Existence of a Neutron». Nature 129 (3252). doi:10.1038/129312a0. .
- ↑ Schrödinger, Erwin (1926). «Quantisation as an Eigenvalue Problem». Annalen der Physik 81 (18): 109–139. doi:10.1002/andp.19263861802. .
- ↑ Mahanti, Subodh. Erwin Schrödinger: The Founder of Quantum Wave Mechanics. Архивировано 17 апреля 2009 года. Дата обращения 1 августа 2009.
- ↑ Mahanti, Subodh. Max Born: Founder of Lattice Dynamics. Архивировано 22 января 2009 года. Дата обращения 1 августа 2009.
- ↑ Greiner, Walter. Quantum Mechanics: An Introduction (4 October 2000). Архивировано 27 октября 2021 года. Дата обращения 14 июня 2010.
- ↑ Heisenberg (1927). «Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik» (de). Zeitschrift für Physik 43 (3–4): 172–198. doi:10.1007/BF01397280. .
- ↑ Milton Orchin. The Vocabulary and Concepts of Organic Chemistry, Second Edition. Архивировано 8 октября 2018 года. Дата обращения 14 июня 2010.
Библиография
- Andrew G. van Melsen. From Atomos to Atom: The History of the Concept Atom. — 1960. — ISBN 0-486-49584-1.
- J. P. Millington. John Dalton. — 1906.
- Jaume Navarro. A History of the Electron: J. J. and G. P. Thomson. — 2012. — ISBN 978-1-107-00522-8.
- Dalton, John. A New System of Chemical Philosophy ... : [англ.]. — S. Russell, 1808.
- Heilbron, J. L. Ernest Rutherford: and the explosion of atoms. — Oxford New York : Oxford University Press, 2003. — ISBN 0195123786.
- Bernard Pullman (1998) The Atom in the History of Human Thought, trans. by Axel Reisinger. Oxford Univ. Press.
- Eric Scerri (2007) The Periodic Table, Its Story and Its Significance, Oxford University Press, New York.
- Charles Adolphe Wurtz (1881) The Atomic Theory, D. Appleton and Company, New York.
- Alan J. Rocke (1984) Chemical Atomism in the Nineteenth Century: From Dalton to Cannizzaro, Ohio State University Press, Columbus (open access full text at http://digital.case.edu/islandora/object/ksl%3Ax633gj985).
Ссылки
- Атомизм С. Марка Коэна.
- Теория атома — подробная информация по теории атома в отношении электронов и электричества.