Карбид кремния
| Карбид кремния | |
|---|---|
 | |
| Физические свойства | |
| Состояние | кристаллы, друзы или кристаллические порошки от прозрачного белого, жёлтого, зелёного или тёмно-синего до чёрного цветов, в зависимости от чистоты, дисперсности, аллотропных и политипных модификаций. |
| Молярная масса | 40.0962 г/моль |
| Плотность | 3,21 г/см³[1] |
| Твёрдость | 9.5 |
| Термические свойства | |
| Температура | |
| • плавления | (с разл.) 2730 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| • в кислотах | нерастворим |
| Оптические свойства | |
| Показатель преломления | 2.55[2] |
| Классификация | |
| Рег. номер CAS | 409-21-2 |
| RTECS | VW0450000 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, в микроэлектронике (в силовых установках электроавтомобилей), для имитирующих алмаз вставок в ювелирные украшения.
Открытие и начало производства

О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год)[3]. Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893[4]. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива[5].
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках[6]. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году[7].
Формы нахождения в природе

Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в виде небольших шестиугольных пластинчатых включений в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был назван минерал в 1905 году[8]. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество)[9].
Хоть карбид кремния и является редким веществом на Земле, он широко распространён в космосе. Это вещество встречается в пылевых облаках вокруг богатых углеродом звёзд, также его много в первозданных, не подвергшихся изменениям, метеоритах (почти исключительно в форме бета-полиморфа). Анализ зёрен карбида кремния, найденных в углеродистом хондритовом метеорите Мёрчисон, показал аномальное изотопное соотношение углерода и кремния, что указывает на происхождение данного вещества за пределами Солнечной системы: 99 % зёрен SiC образовалось около богатых углеродом звёзд, принадлежащих к асимптотической ветви гигантов[10]. Карбид кремния можно часто обнаружить вокруг таких звёзд по их ИК-спектрам[11].
Производство
Из-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
- [math]\displaystyle{ \mathsf{SiO_2 + 3C\ \xrightarrow{1600-2500^oC}\ SiC + 2CO\!\uparrow} }[/math]

Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала[12].

Чистый карбид кремния можно получить с помощью так называемого процесса Лели[13], в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре[14]. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров[12][15].
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику[16][17][18][19].
Структура и свойства
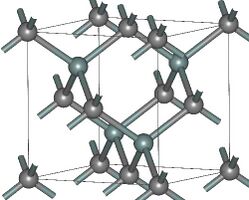
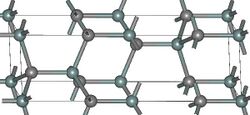
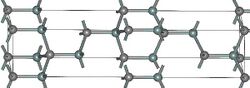
- Структуры основных политипов SiC
-
(β)3C-SiC
-
4H-SiC
-
(α)6H-SiC
Известно примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности[21].
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C[22]. До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается. Нагревание бета-формы до температур свыше 1700 °C способно приводить к постепенному переходу кубической бета-формы в гексагональную (2Н, 4Н, 6Н, 8Н) и ромбичеcкую (15R).[23] При повышении температуры и времени процесса все образующиеся формы переходят в конечном итоге в гексагональный альфа-политип 6Н.[24]
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристаллическая структура | Цинковая обманка (кубич.) | Гексагональная | Гексагональная |
| Пространственная группа | [math]\displaystyle{ \mathsf{T^2_d-F43m} }[/math] | [math]\displaystyle{ \mathsf{C^4_{6v}-P6_3mc} }[/math] | [math]\displaystyle{ \mathsf{C^4_{6v}-P6_3mc} }[/math] |
| Символ Пирсона | [math]\displaystyle{ \mathsf{cF8} }[/math] | [math]\displaystyle{ \mathsf{hP8} }[/math] | [math]\displaystyle{ \mathsf{hP12} }[/math] |
| Постоянные решётки (Å) | [math]\displaystyle{ 4.3596 }[/math] | [math]\displaystyle{ 3.0730; 10.053 }[/math] | [math]\displaystyle{ 3.0810; 15.12 }[/math] |
| Плотность (г/см³) | 3.21 | 3.21 | 3.21 |
| Ширина запрещённой зоны (эВ) | 2.36 | 3.23 | 3.05 |
| МОС (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт/(см·К)) | 3.6 | 3.7 | 4.9 |
Чистый карбид кремния бесцветен. Его оттенки от коричневого до чёрного цвета связаны с примесями железа. Радужный блеск кристаллов обусловливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя.
Карбид кремния является весьма инертным химическим веществом: практически не взаимодействует с большинством кислот, кроме концентрированных фтористоводородной (плавиковой), азотной и ортофосфорной кислот. Способен выдерживать нагревание на открытом воздухе до температур порядка 1500 °C. Карбид кремния не плавится при любом известном давлении, но способен сублимировать при температурах свыше 1700 °C. Высокая термическая устойчивость карбида кремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей.
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где высокая теплопроводность, высокое электрическое напряжение пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств[27], в том числе при создании сверхмощных светодиодов. Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0⋅10−6K) и в достаточно широком температурном диапазоне эксплуатации он не испытывает фазовых переходов (в том числе фазовых переходов второго рода), из-за которых может произойти разрушение монокристаллов[12].
Электропроводность
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей. Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия[2]. Металлическая проводимость была достигнута за счёт сильного легирования бором, алюминием и азотом.
Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К[28].
Физические свойства
Карбид кремния является твердым, тугоплавким веществом. Кристаллическая решётка аналогична решётке алмаза. Является полупроводником.[29]
- Стандартная энтальпия образования (298 К, кДж/моль): −66,1[30]
- Стандартная энергия Гиббса образования (298 К, кДж/моль): −63,7[30]
- Стандартная энтропия образования (298 К, Дж/моль·K): 16,61[30]
- Стандартная мольная теплоемкость (298 К, Дж/моль·K): 26,86[30]
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/г·форм[31]
Химические свойства
Карбид кремния является единственным бинарным соединением, образуемым элементами IV группы Периодической таблицы элементов Д. И. Менделеева. По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленной некоторым различием в электроотрицательностях атомов Si и C, не превышает 10—12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твердостью. В инертной атмосфере карбид кремния разлагается только при очень высокой температуре:
- [math]\displaystyle{ \mathsf{SiC \ \xrightarrow{2830^\circ C} \ Si +C} }[/math]
Сильно перегретый пар разлагает карбид кремния:
- [math]\displaystyle{ \mathsf{SiC + 2H_2O \ \xrightarrow{1300^\circ C} \ SiO_2 + CH_4\!\uparrow} }[/math]
Концентрированные кислоты и их смеси растворяют карбид кремния:
- [math]\displaystyle{ \mathsf{3SiC + 8HNO_3 \longrightarrow 3SiO_2 + 3CO_2\!\uparrow + 8NO\!\uparrow + 4H_2O} }[/math]
- [math]\displaystyle{ \mathsf{3SiC + 18HF + 8HNO_3 \longrightarrow 3H_2[SiF_6] + 3CO_2\!\uparrow + 8NO\!\uparrow + 10H_2O} }[/math]
В присутствии кислорода щёлочи растворяют карбид кремния:
- [math]\displaystyle{ \mathsf{SiC + 2NaOH + 2O_2 \rightarrow Na_2SiO_3 + CO_2\!\uparrow + H_2O} }[/math]
- [math]\displaystyle{ \mathsf{SiC + 4NaOH + 2O_2 \ \xrightarrow{t\gt 350^oC} \ Na_2SiO_3 + Na_2CO_3 + 2H_2O} }[/math]
При нагревании реагирует с кислородом:
- [math]\displaystyle{ \mathsf{2SiC + 3O_2 \ \xrightarrow{950-1700^\circ C} \ 2SiO_2 + 2CO\!\uparrow } }[/math]
- с галогенами:
- [math]\displaystyle{ \mathsf{SiC + 2Cl_2 \ \xrightarrow{600-1200^\circ C} \ SiCl_4 + C } }[/math]
- с азотом, образуя нитрид кремния:
- [math]\displaystyle{ \mathsf{6SiC + 7N_2 \ \xrightarrow{1000-1400^\circ C} \ 2Si_3N_4 + 3C_2N_2 } }[/math]
- с активными металлами:
- [math]\displaystyle{ \mathsf{2SiC + 5Mg \ \xrightarrow{700^\circ C} \ 2Mg_2Si + MgC_2 } }[/math]
- и их пероксидами:
- [math]\displaystyle{ \mathsf{SiC + 4Na_2O_2 \ \xrightarrow{700-800^\circ C} \ Na_2SiO_3 + Na_2CO_3 + 2Na_2O } }[/math]
Применение
Абразивные и режущие инструменты

В современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости. В обрабатывающей промышленности из-за его высокой твердости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки[32].
Суспензии мелкодисперсных порошков карбида кремния в масле, глицерине или этиленгликоле используются в процессе проволочной резки полупроводниковых монокристаллов на пластины.
В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей [33].
Конструкционные материалы

Карбид кремния наряду с карбидом вольфрама и другими износостойкими материалами применяется для создания торцевых механических уплотнений.
В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе. Планировалось, что разработанные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов. Тем не менее, ни один из этих проектов не привёл к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния[34].
Подобно другим высокотвердым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Шкура дракона», созданном компанией Pinnacle Armor, используются диски из карбида кремния[35].
Автомотодетали

Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод», становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе Porsche Carrera GT, Bugatti Veyron, Chevrolet Corvette ZR1, Bentley, Ferrari, Lamborghini[36]. Карбид кремния используется также в спечённых формах в дизельных фильтрах для очистки от твердых частиц[37]. [уточнить]
Электроника и электротехника
Первыми электрическими устройствами из SiC были нелинейные элементы варисторы и вентильные разрядники (см. также: тирит, вилит, лэтин, силит) для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита — смеси SiC и связующего. Варистор обладает высоким сопротивлением до тех пор, пока напряжение на нём не достигнет определённого порогового значения VT, после чего его сопротивление падает до более низкого уровня и поддерживает это значение, пока приложенное напряжение не упадёт ниже VT[38].
- Электронные приборы

Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, n-МОП транзисторах и в высокотемпературных тиристорах[39]. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества:
- в несколько раз большая ширина запрещённой зоны;
- в 10 раз большая электрическая прочность;
- высокие допустимые рабочие температуры (до 600 °C);
- теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия;
- устойчивость к воздействию радиации;
- стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени.
Из почти двухсот пятидесяти модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC.
Проблемы с интерфейсом элементов, основанных на диоксиде кремния, препятствуют развитию n-МОП транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро[40].
История светодиодов из SiC весьма примечательна: впервые свечение в SiC было обнаружено Х. Роундом в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Жёлтые светодиоды из 3C-SiC были изготовлены в СССР в 1970-х годах[41], а синие (из 6H-SiC), по всему миру — в 1980-х[42]. Производство вскоре остановилось, потому что нитрид галлия показал в 10—100 раз более яркую эмиссию. Эта разница в эффективности связана с неблагоприятной непрямой запрещённой зоной SiC, в то время как нитрид галлия имеет прямую запрещённую зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по-прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах[42].
Астрономия и точная оптика
Жесткость, высокая теплопроводность и низкий коэффициент теплового расширения делают карбид кремния термостабильным материалом в широком диапазоне рабочих температур. Это обуславливает широкое применение карбидкремниевых матриц для изготовления зеркальных элементов в различных оптических системах, например в астрономических телескопах или в системах передачи энергии с использованием лазерного излучения. Развитие технологий (химическое осаждение паров) позволяет создавать диски из поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркал могут формироваться различными методами, включая прессование чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов, например Gaia, уже оснащены оптикой из карбида кремния, покрытого серебром[43][44].
Пирометрия

Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K[45][46].
Нагревательные элементы
Первые упоминания об использовании карбида кремния для изготовления нагревательных элементов относятся к началу 20 века, когда они были изготовлены The Carborundum Company в США и EKL в Берлине[источник не указан 3677 дней].
В настоящее время карбид кремния является одним из типичных материалов для изготовления нагревательных элементов, способных работать при температурах до 1400 °C на воздухе и до 2000 °C в нейтральной или восстановительной среде[источник не указан 3677 дней], что заметно выше, чем доступно для многих металлических нагревателей[источник не указан 3677 дней].
Нагревательные элементы из карбида кремния используются при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т. д.[47]
Ядерная энергетика
Благодаря высокой устойчивости к воздействию внешних неблагоприятных факторов, включая природные, высокой прочности и твердости, низкому коэффициенту термического расширения и низкому коэффициенту диффузии примесей и продуктов деления реакционноспечённый карбид кремния нашёл применение в ядерной энергетике[48].
Карбид кремния, наряду с другими материалами, используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных реакторах, в том числе в газоохлаждаемых реакторах.
Из карбида кремния изготавливаются пеналы для длительного хранения и захоронения ядерных отходов.
Ювелирные изделия

Как ювелирный камень карбид кремния используется в ювелирном деле: называется «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и тверд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза).
Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление. Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях. По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления. Муассанит имеет более низкую плотность 3,21 г/см³ (против 3,53 г/см³ для алмаза) и гораздо более устойчив к теплу. В результате получается камень с большим блеском минерала, с четкими гранями и хорошей устойчивостью к внешним воздействиям. В отличие от алмаза, который горит при температуре 800 °C, муассанит остаётся неповреждённым вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота). Муассанит стал популярен как заменитель алмаза, и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зелёной или жёлтой флуоресценции в ультрафиолетовом свете[49].
Производство стали
Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище, чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом[50].
Катализатор
Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид[51][52].
Производство графена
Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений[53][54]. Высокая температура (2830 °C, как выше указано в реакции) приводит к разложению карбида кремния. Кремний как более летучий элемент уходит из приповерхностных слоёв, оставляя моно- или полислойный графен, нижние из которых сильно связаны с объёмным кристалом. В качестве исходного материала используют монокристаллы 6H-SiC(0001), на поверхности которых формировались террасы графена в результате термообработки с размерами около 1 микрона, разделённые областями с несколькими слоями[55].
Применение в строительстве
Может использоваться в качестве фибры в фибробетоне (аналогично базальтовому волокну)[56].
См. также
Примечания
- ↑ Patnaik, P. Handbook of Inorganic Chemicals (англ.). — McGraw-Hill Education, 2002. — ISBN 0070494398.
- ↑ 2,0 2,1 Properties of Silicon Carbide (SiC). Ioffe Institute. Архивировано 24 апреля 2012 года.
- ↑ Weimer, A. W. Carbide, nitride, and boride materials synthesis and processing (англ.). — Springer, 1997. — P. 115. — ISBN 0412540606.
- ↑ Acheson, G. (1893) U.S. Patent 492 767 «Production of artificial crystalline carbonaceous material»
- ↑ The Manufacture of Carborundum — a New Industry (4 июля 1894). Архивировано 23 января 2009 года.
- ↑ Dunwoody, Henry H.C. (1906) U.S. Patent 837 616 «Wireless telegraph system» (silicon carbide detector)
- ↑ Hart, Jeffrey A.; Stefanie Ann Lenway, Thomas Murtha. A History of Electroluminescent Displays. Архивировано 24 апреля 2012 года.
- ↑ Moissan, Henri. Nouvelles recherches sur la météorité de Cañon Diablo (фр.) // Comptes rendus : magazine. — 1904. — Vol. 139. — P. 773—786.
- ↑ Di Pierro S. et al. Rock-forming moissanite (natural α-silicon carbide) (итал.) // American Mineralogist : diario. — 2003. — V. 88. — P. 1817—1821.
- ↑ Alexander C. M. O'D. In situ measurement of interstellar silicon carbide in two CM chondrite meteorites (англ.) // Nature : journal. — 1990. — Vol. 348. — P. 715—717. — doi:10.1038/348715a0.
- ↑ Jim Kelly. The Astrophysical Nature of Silicon Carbide. Архивировано 4 мая 2017 года.
- ↑ 12,0 12,1 12,2 Harris, Gary Lynn. Свойства карбида кремния = Properties of silicon carbide. — United Kingdom: IEE, 1995. — 282 с. — P. 19; 170–180. — ISBN 0852968701.
- ↑ Lely, Jan Anthony. Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen (нем.) // Журнал Berichte der Deutschen Keramischen Gesellschaft. — 1955. — H. 32. — S. 229—236.
- ↑ N.Ohtani, T.Fujimoto, T.Aigo, M.Katsuno, H.Tsuge, H.Yashiro. Large high-quality silicon carbide substrates (англ.) // Nippon Steel Technical Report no. 84. — 2001. Архивировано 4 марта 2012 года.
- ↑ Byrappa, K.; Ohachi, T. Crystal growth technology. — Springer, 2003. — С. 180—200. — ISBN 3540003673.
- ↑ Pitcher, M. W.; Joray, S. J.; Bianconi, P. A. Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne) // журнал Advanced Materials. — 2004. — С. 706. — doi:10.1002/adma.200306467.
- ↑ Park, Yoon-Soo. SiC materials and devices. — Academic Press, 1998. — С. 20—60. — ISBN 0127521607.
- ↑ Bunsell, A. R.; Piant, A. A review of the development of three generations of small diameter silicon carbide fibres // Journal of Materials Science. — 2006. — С. 823. — doi:10.1007/s10853-006-6566-z.
- ↑ Laine, Richard M. Preceramic polymer routes to silicon carbide. — Babonneau, Florence: Chemistry of Materials, 1993. — С. 260. — doi:10.1021/cm00027a007.
- ↑ Cheung, Rebecca. Silicon carbide microelectromechanical systems for harsh environments (англ.). — Imperial College Press, 2006. — P. 3. — ISBN 1860946240.
- ↑ Morkoç, H.; Strite, S.; Gao, G. B.; Lin, M. E.; Sverdlov, B.; Burns, M. Large-band-gap SiC, III-V nitride, and II-VI ZnSe-based semiconductor device technologies. — Journal of Applied Physics, 1994. — С. 1363. — doi:10.1063/1.358463.
- ↑ Muranaka, T. Superconductivity in carrier-doped silicon carbide : free download. — Sci. Technol. Adv. Mater., 2008. — doi:10.1088/1468-6996/9/4/044204.
- ↑ стр. 119—128 в «Карбид кремния» под ред. Г.Хенита и Р.Рол, пер. с англ.; М. Мир: 1972 349с., с ил.
- ↑ Г. Г. Гнесин «Карбидокремниевые материалы» М. Металлургия: 1977, 216с, с ил.
- ↑ Properties of Silicon Carbide (SiC). Ioffe Institute. Дата обращения: 6 июня 2009. Архивировано 24 апреля 2012 года.
- ↑ Yoon-Soo Park, Willardson, Eicke R Weber. SiC materials and devices (англ.). — Academic Press, 1998. — P. 1—18. — ISBN 0127521607.
- ↑ Bhatnagar, M.; Baliga, B.J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices. — IEEE Transactions on Electron Devices, Март 1993. — Вып. 3. — С. 645—655. — doi:10.1109/16.199372.
- ↑ Kriener, M. Superconductivity in heavily boron-doped silicon carbide (англ.) // Sci. Technol. Adv. Mater. : журнал. — 2008. — Вып. 9. — С. 044205. — doi:10.1088/1468-6996/9/4/044205.
- ↑ Важнейшие соединения кремния (недоступная ссылка). Дата обращения: 24 мая 2010. Архивировано 13 октября 2007 года.
- ↑ 30,0 30,1 30,2 30,3 Рабинович, В. А. Кремния карбид // Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. — Л. : Химия, 1977. — С. 74.
- ↑ А. М. Голуб. Общая и неорганическая химия = Загальна та неорганична хімія. — Вища школа, 1971. — С. 227. — 443 с. — 6700 экз.
- ↑ Fuster, Marco A. (1997) «Skateboard grip tape», U.S. Patent 5 622 759
- ↑ Bansal, Narottam P. Handbook of ceramic composites (англ.). — Springer, 2005. — P. 312. — ISBN 1402081332.
- ↑ Ceramics for turbine engines. Архивировано 6 апреля 2009 года.
- ↑ Dragon Skin – Most Protective Body Armor – Lightweight. Future Firepower. Архивировано 24 апреля 2012 года.
- ↑ Top 10 Fast Cars (недоступная ссылка). Архивировано 26 августа 2009 года.
- ↑ O'Sullivan, D.; Pomeroy, M.J.; Hampshire, S.; Murtagh, M.J. Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits // MRS proceedings. — 2004. — Вып. 19. — С. 2913—2921. — doi:10.1557/JMR.2004.0373.
- ↑ Whitaker, Jerry C. The electronics handbook. — CRC Press, 2005. — С. 1108. — ISBN 0849318890.
- ↑ Bhatnagar, M.; Baliga, B.J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices // IEEE Transactions on Electron Devices. — март, 1993. — Вып. 3. — С. 645—655. — doi:10.1109/16.199372.
- ↑ Madar, Roland. Materials science: Silicon carbide in contention : Журнал Nature. — 2004-08-26. — Вып. 430. — С. 974—975. — doi:10.1038/430974a.
- ↑ Yellow SiC LED. Архивировано 24 апреля 2012 года.
- ↑ 42,0 42,1 Stringfellow, Gerald B. High brightness light emitting diodes (англ.). — Academic Press, 1997. — P. 48, 57, 425. — ISBN 0127521569.
- ↑ The largest telescope mirror ever put into space, European Space Agency. Архивировано 19 октября 2012 года. Дата обращения 3 мая 2010.
- ↑ Petrovsky, G. T. 2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope // Journal Proc. SPIE. — С. 263.
- ↑ Thin-Filament Pyrometry Developed for Measuring Temperatures in Flames (англ.), NASA. Архивировано 15 марта 2012 года. Дата обращения 3 мая 2010.
- ↑ Maun, Jignesh D.; Sunderland, PB; Urban, DL. Thin-filament pyrometry with a digital still camera // Applied Optics. — 2007. — Вып. 4. — С. 483. — doi:10.1364/AO.46.000483. — PMID 17230239.
- ↑ Yeshvant V. Deshmukh. Industrial heating: principles, techniques, materials, applications, and design. — CRC Press, 2005. — С. 383—393. — ISBN 0849334055.
- ↑ López-Honorato, E. TRISO coated fuel particles with enhanced SiC properties // Journal of Nuclear Materials : журнал. — 2009. — С. 219. — doi:10.1016/j.jnucmat.2009.03.013.
- ↑ O'Donoghue, M. Gems. — Elsevier. — 2006. — С. 89. — ISBN 0-75-065856-8.
- ↑ Silicon carbide (steel industry) (англ.). Архивировано 24 апреля 2012 года.
- ↑ Rase, Howard F. Handbook of commercial catalysts : heterogeneous catalysts : [англ.]. — CRC Press, 2000. — P. 258. — ISBN 0849394171.
- ↑ Singh, S. K. High surface area silicon carbide from rice husk : A support material for catalysts : [англ.] / S. K. Singh, K. M. Parida, B. C. Mohanty … [et al.] // Reaction Kinetics and Catalysis Letters. — 1995. — Vol. 54. — P. 29–34. — doi:10.1007/BF02071177.
- ↑ de Heer, Walt A. Handbook of Nanophysics (англ.). — Epitaxial graphene: Taylor and Francis, 2010. — ISBN 1420075381. (недоступная ссылка)
- ↑ de Heer, Walt A. Epitaxial graphene (англ.) // Solid State Communications. — 2007. — P. 92. — doi:10.1016/j.ssc.2007.04.023. Архивировано 9 декабря 2008 года.
- ↑ Елецкий А. В., Искандарова И. М., Книжник А. А., Красиков Д. Н. Графен: методы получения и теплофизические свойства // Успехи физических наук. — Российская академия наук, 2011. — Т. 181. — С. 227—258. — doi:10.3367/UFNr.0181.201103a.0233.
- ↑ 212. К. А. Сарайкина, В. А. Шаманов Дисперсное армирование бетонов // Вестник ПГТУ. Урбанистика. 2011. № 2.
Ссылки
- Kelly, Jim. A brief history of SiC : [арх. 19.01.2008] // Jim Kelly's filing cabinet. — Department of Chemistry, University College London, 2005. — 16 мая. — Дата обращения: 23.06.2020.
- Карбид кремния: технология, свойства, применение / Под ред. Беляева А. Е., Конаковой Р. В. — Харьков: ИСМА, 2010. — 532 с. — ISBN 978-966-02-5445-9
- Дигонский С. В. Газофазные процессы синтеза и спекания тугоплавких веществ. — М.: ГЕОС, 2013. — 462 с.