Интерферон гамма
| Интерферон гамма | |
|---|---|
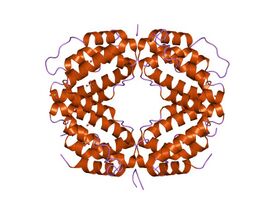 Кристаллическая структура биологически активной одноцепочечной мутации интерферона человека Кристаллическая структура биологически активной одноцепочечной мутации интерферона человека | |
| Идентификаторы | |
| Символ | IFN gamma |
| Pfam | PF00714 |
| Pfam clan | CL0053 |
| InterPro | IPR002069 |
| SCOP | 1rfb |
| SUPERFAMILY | 1rfb |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Интерферон гамма (IFNγ) – это димеризованный растворимый цитокин, который является единственным членом класса интерферонов II типа.[1] Э. Ф. Уилок обнаружил этот интерферон, который в начале своей истории был известен как иммунный интерферон. Он описал его как продукт человеческих лейкоцитов, стимулированных фитогемагглютинином. Впоследствии его назвали продуктом антиген-стимулированных лимфоцитов.[2] Также было выявлено, что он продуцируется в лимфоцитах человека,[3] туберкулин-сенсибилизированных перитонеальных лимфоцитах мыши,[4] заражённых PPD; результаты показали, что полученные супернатанты ингибируют рост вируса везикулярного стоматита. Эти отчёты также содержали основные наблюдения, лежащие в основе широко применяемого в настоящее время анализа высвобождения гамма-интерферона, используемого для тестирования на туберкулёз. У людей белок IFNγ закодирован в гене IFNG[5][6]
Функция
IFNγ, интерферон II типа, это цитокин, который имеет решающее значение для врождённого и приобретённого иммунитета против вирусных, некоторых бактериальных и протозойных инфекций. IFNγ является важным активатором макрофагов и индуктором экспрессии молекул главного комплекса гистосовместимости II класса (MHC). Аберрантная экспрессия IFNγ ассоциирована с рядом аутовоспалительных и аутоиммунных заболеваний. Важность IFNγ в иммунной системе частично обусловлена его способностью непосредственно ингибировать репликацию вируса и, самое главное, его иммуностимулирующим и иммуномодулирующим действием. IFNγ продуцируется преимущественно естественными киллерами (NK) и естественными Т-киллерами (NKT) как часть врождённого иммунного ответа, а также эффекторными Т-клетками CD4 Th1 и CD8 цитотоксических Т-лимфоцитов (CTL) после развития антигенспецифического иммунитета [7][8] как часть адаптивного иммунного ответа. IFNγ также продуцируется нецитотоксическими врождёнными лимфоидными клетками (ILC), семейством иммунных клеток, впервые обнаруженных в начале 2010-х годов.[9]
Структура
IFNγ мономер состоит из ядра из шести α-спиралей и расширенной развёрнутой последовательности в С-концевой области.[10][11] Это показано в структурных моделях ниже. α-спирали в ядре структуры пронумерованы от 1 до 6.

Биологически активный димер образуется путём антипараллельного взаимоблокирования двух мономеров, как показано ниже. В нарисованной модели один мономер показан красным цветом, другой – синим.

Связывание рецепторов
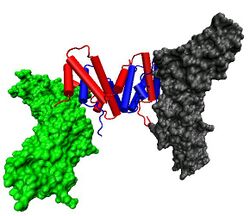
Клеточные реакции на IFNγ активируются путём его взаимодействия с гетеродимерным рецептором, состоящим из рецептора интерферона гамма 1 (ИФНГР1) и рецептора интерферона гамма 2 ((ИФНГР2). Связывание IFNγ с рецептором активирует сигнальный путь JAK/STAT. IFNγ также связывается с гепарансульфат гликозаминогликаном (HS) на поверхности клетки. Однако в отличие от многих других гепарансульфатствязывающих белков, где связывание способствует биологической активности, связывание IFNγ с HS ингибирует его биологическую активность.[12]
Структурные модели, показанные на рис. 1-3 для IFNγ[11], все укорочены на своих С-концах 17-тью аминокислотами. Полная длина IFNγ составляет 143 аминокислоты в длину, модели - 126 аминокислот в длину. Аффиность к гепарансульфату находится исключительно в пределах удалённой последовательности из 17 аминокислот. .[13] В этой последовательности из 17 аминокислот лежат два кластера основных аминокислот, называемых D1 и D2 соответственно.[14] Гепарансульфат взаимодействует с обоими этими кластерами.[12] В отсутствие гепарансульфата присутствие последовательности D1 увеличивает скорость образования комплексов IFNγ-рецепторов. [12] Связываясь с D1, HS может конкурировать с рецептором и препятствовать образованию активных рецепторных комплексов.
Биологическое значение взаимодействия гепарансульфатов с IFNγ неясно, однако связывание кластера D1 с HS может защитить его от протеолитического расщепления.[14]
Биологическая активность
IFNγ секретируется T-хелперами (в частности, Th1-клетками), цитотоксическими Т-лимфоцитами (TC-клетки), макрофагами, эпителиоцитами слизистой оболочки и естественными киллерами. IFNγ является единственным II Типом интерферона, и серологически отличается от интерферонов I Типа; он является кислотно-лабильным, в то время как I Тип, кислотно-стабильный.
IFNγ обладает противовирусными, иммунорегулирующими и противоопухолевыми свойствами. [15] Он изменяет транскрипцию до 30 генов, вызывая различные физиологические и клеточные реакции.
К числу таких свойств относятся:
- Способствует активности естественных клеток[источник не указан 1531 день].
- Повышает антигенное проявление и лизосомную активность макрофагов.
- Активирует индуцибельную синтазу оксида азота (iNOS)
- Индуцирует выработку IgG2a и IgG3 из активированных плазматических B-лимфоцитов
- Заставляет нормальные клетки увеличивать экспрессию молекул MHC класса I, а также MHC класса II на антигенпрезентирующих клетках быть специфичными, посредством индукции генов обработки антигена, включая субъединицы иммунопротеасомы (MECL1, LMP2, LMP7), а также TAP и ERAAP в дополнение, возможно, к прямой регуляции тяжёлых цепей MHC и самого B2-микроглобулина
- Способствует адгезии и связыванию необходимых для миграции лейкоцитов
- Индуцирует экспрессию внутренних факторов защиты: например, в отношении ретровирусов соответствующие гены включают TRIM5alpha, APOBEC и тетерин, представляющие непосредственно противовирусные эффекты
- Простые альвеолярные макрофаги против вторичных бактериальных инфекций. [16][17]
- IFNγ является основным цитокином, определяющим Th1-клетки: Th1 -клетки секретируют IFNγ, который, в свою очередь, заставляет более недифференцированные CD4+-клетки (Th0-клетки) дифференцироваться в Th1-клетки, представляя собой петлю положительной обратной связи, подавляя дифференцировку Th2-клеток. (Эквивалентные определения цитокинов для других клеток включает в себя: IL-4 в Th2-клеток, IL-17 и T-хелперы 17.)
Естественные клетки и цитотоксические Т-лимфоциты также продуцируют IFNγ. IFNγ подавляет образование остеокластов, быстро деградируя RANK адапторного белка TRAF6 в сигнальном пути RANK-RANKL, который в противном случае стимулирует выработку NF-κB.
Активность в образовании гранулём
Гранулёма – это ответная реакция организма на вещество, которое он не может удалить или стерилизовать. Инфекционные причины гранулём (инфекции обычно являются наиболее распространённой причиной гранулём) включают: туберкулёз, лепра, гистоплазмоз, криптококкоз, кокцидиоидомикоз, бластомикоз и токсоплазмоз. Примерами неинфекционных гранулёматозных заболеваний являются саркоидоз, болезнь Крона, бериллиоз, гигантоклеточный артериит, гранулёматоз с полиангиитом, гранулёматоз Вегенера, лёгочные ревматоидные узелки и аспирация пищи и других твёрдых частиц в лёгкие. Инфекционная патофизиология гранулём обсуждается здесь в первую очередь.
Ключевая связь между IFNγ и гранулёмами заключается в том, что IFNγ активирует макрофаги, так что они становятся более мощными в уничтожении внутриклеточных организмов. Активация макрофагов IFN γ из h1 –хелперов при микобактериальных инфекциях позволяет макрофагам преодолеть ингибирование созревания фаголизосом, вызванное микобактериями (оставаться живыми внутри макрофагов). Первыми шагами в формировании IFNγ -индуцированной гранулёмы являются активация Th1-хелперов макрофагами, высвобождающими IL-1 и IL-12 в присутствии внутриклеточных патогенов, и презентация антигенов этих патогенов. Затем Th1-хелперы объединяются вокруг макрофагов и высвобождают IFNγ, который активирует макрофаги. Впоследствии активация макрофагов вызывает цикл дальнейшего уничтожения внутриклеточных бактерий и дальнейшей презентации антигенов Th1-хелперам с дальнейшим высвобождением IFNγ. Наконец, макрофаги окружают Th1-хелперы и становятся фибробластоподобными клетками, ограждающими инфекцию.
Активность во время беременности
Естественные киллеры матки (NK) выделяют высокие уровни хемотаксисов, таких как IFNγ. IFNγ расширяет и истончает стенки спиральных артерий матери, чтобы усилить приток крови к месту имплантации. Это ремоделирование помогает развитию плаценты, поскольку она вторгается в матку в поисках питательных веществ. Мыши с нокаутом IFNγ не могут инициировать во время беременности нормальную модификацию децидуальных артерий. Эти модели показывают аномально низкое количество клеток или некроз децидуальной оболочки.[18]
Производство
Рекомбинантный человеческий интерферон гамма, как дорогостоящий биофармацевтический препарат, проявляется в различных системах экспрессии, включая прокариотические, простейшие, грибковые (дрожжи), растительные, насекомые и клетки млекопитающих. Человеческий интерферон гамма обычно экспрессируется в кишечную палочку, продаваемую как ACTIMMUNE®, однако полученный продукт прокариотической экспрессионной системы не гликозилируется с коротким периодом полураспада в кровотоке после инъекции; процесс очистки от бактериальной экспрессионной системы также очень дорогостоящий. Другие системы экспрессии, такие как Pichia pastoris, не показали удовлетворительных результатов с точки зрения урожайности.[19][20]
Потенциальное использование в иммунотерапии
Интерферон гамма ещё пока не одобрен для лечения ни в одной иммунотерапии рака. Однако улучшение выживаемости наблюдалось при введении интерферона гамма пациентам с раком мочевого пузыря и меланомой. Наиболее многообещающий результат был достигнут у пациенток со 2-й и 3-й стадиями рака яичников. Напротив, подчёркивалось: «Интерферон-γ, секретируемый CD8-позитивными лимфоцитами, усиливает регуляцию PD-L1 на раковых клетках яичников и способствует росту опухоли» [21] Исследование in vitro ИФН-гамма в раковых клетках довольно обширны, и результаты указывают на антипролиферативную активность ИФН-гаммы, приводящую к ингибированию роста или гибели клеток, обычно индуцируемой апоптозом, но иногда и аутофагией.[19] Кроме того, известно, что у млекопитающих происходит гликозилирование рекомбинантного человеческого интерферона гамма, экспрессируемого в HEK 293, что повышает его терапевтическую эффективность по сравнению с негликозилированной формой, которая экспрессируется в кишечной палочке.[22]
Взаимодействия
Было выяснено, что интерферон-γ взаимодействует с интерфероновым гамма-рецептором 1.[23][24]
Болезни
Интерферон-γ играет решающую роль в иммунном ответе против некоторых внутриклеточных патогенов, включая болезнь Шагаса.[25] Он также играет определённую роль в себорейном дерматите.[26]
Регулирование
Существуют доказательства того, что экспрессия интерферона гамма регулируется псевдозависимым элементом в его 5' UTR,[27] а также прямо или косвенно микроРНК: miR-29.[28] Экспрессия этого интерферона регулируется через GAPDH в Т-клетках.. Это взаимодействие происходит в 3'UTR, где связывание GAPDH препятствует трансляции последовательности мРНК.[29]
Примечания
- ↑ (August 1982) «Structure of the human immune interferon gene». Nature 298 (5877): 859–63. doi:10.1038/298859a0. PMID 6180322. .
- ↑ (July 1965) «Interferon-Like Virus-Inhibitor Induced in Human Leukocytes by Phytohemagglutinin». Science 149 (3681): 310–1. doi:10.1126/science.149.3681.310. PMID 17838106. .
- ↑ (June 1969) «Immune specific induction of interferon production in cultures of human blood lymphocytes». Science 164 (3886): 1415–7. doi:10.1126/science.164.3886.1415. PMID 5783715. .
- ↑ (November 1970) «Release of virus inhibitor from tuberculin-sensitized peritoneal cells stimulated by antigen». Journal of Immunology 105 (5): 1068–71. PMID 4321289.
- ↑ (March 1983) «Human immune interferon gene is located on chromosome 12». The Journal of Experimental Medicine 157 (3): 1020–7. doi:10.1084/jem.157.3.1020. PMID 6403645.
- ↑ Entrez Gene: IFNGR2.
- ↑ Entrez Gene: INFG.
- ↑ Regulation of Interferon‐γ During Innate and Adaptive Immune Responses // Regulation of interferon-gamma during innate and adaptive immune responses. — 2007. — Vol. 96. — P. 41–101. — ISBN 978-0-12-373709-0. — doi:10.1016/S0065-2776(07)96002-2.
- ↑ (January 2015) «The biology of innate lymphoid cells». Nature 517 (7534): 293–301. doi:10.1038/nature14189. PMID 25592534. .
- ↑ (May 1991) «Three-dimensional structure of recombinant human interferon-gamma». Science 252 (5006): 698–702. doi:10.1126/science.1902591. PMID 1902591. .
- ↑ 11,0 11,1 11,2 11,3 11,4 PDB 1FG9; (September 2000) «Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex». Structure 8 (9): 927–36. doi:10.1016/S0969-2126(00)00184-2. PMID 10986460.
- ↑ 12,0 12,1 12,2 (May 1998) «The heparan sulfate binding sequence of interferon-gamma increased the on rate of the interferon-gamma-interferon-gamma receptor complex formation». The Journal of Biological Chemistry 273 (18): 10919–25. doi:10.1074/jbc.273.18.10919. PMID 9556569.
- ↑ (November 2004) «NMR characterization of the interaction between the C-terminal domain of interferon-gamma and heparin-derived oligosaccharides». The Biochemical Journal 384 (Pt 1): 93–9. doi:10.1042/BJ20040757. PMID 15270718.
- ↑ 14,0 14,1 (March 1991) «Interferon-gamma binds to heparan sulfate by a cluster of amino acids located in the C-terminal part of the molecule». FEBS Letters 280 (1): 152–4. doi:10.1016/0014-5793(91)80225-R. PMID 1901275.
- ↑ (February 2004) «Interferon-gamma: an overview of signals, mechanisms and functions». Journal of Leukocyte Biology 75 (2): 163–89. doi:10.1189/jlb.0603252. PMID 14525967.
- ↑ (November 2019) «Tissue-Specific Macrophage Responses to Remote Injury Impact the Outcome of Subsequent Local Immune Challenge». Immunity 51 (5): 899–914.e7. doi:10.1016/j.immuni.2019.10.010. PMID 31732166.
- ↑ (November 2018) «Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity». Cell 175 (6): 1634–1650.e17. doi:10.1016/j.cell.2018.09.042. PMID 30433869.
- ↑ (July 2000) «Interferon gamma contributes to initiation of uterine vascular modification, decidual integrity, and uterine natural killer cell maturation during normal murine pregnancy». The Journal of Experimental Medicine 192 (2): 259–70. doi:10.1084/jem.192.2.259. PMID 10899912.
- ↑ 19,0 19,1 (December 2016) «Review of the recombinant human interferon gamma as an immunotherapeutic: Impacts of production platforms and glycosylation». Journal of Biotechnology 240: 48–60. doi:10.1016/j.jbiotec.2016.10.022. PMID 27794496.
- ↑ (January 2017) «Is Pichia pastoris a realistic platform for industrial production of recombinant human interferon gamma?». Biologicals 45: 52–60. doi:10.1016/j.biologicals.2016.09.015. PMID 27810255.
- ↑ (April 2015) «IFN-γ from lymphocytes induces PD-L1 expression and promotes progression of ovarian cancer». British Journal of Cancer 112 (9): 1501–9. doi:10.1038/bjc.2015.101. PMID 25867264.
- ↑ (October 2017) «Improved therapeutic efficacy of mammalian expressed-recombinant interferon gamma against ovarian cancer cells». Experimental Cell Research 359 (1): 20–29. doi:10.1016/j.yexcr.2017.08.014. PMID 28803068.
- ↑ (September 2000) «Observation of an unexpected third receptor molecule in the crystal structure of human interferon-gamma receptor complex». Structure 8 (9): 927–36. doi:10.1016/S0969-2126(00)00184-2. PMID 10986460.
- ↑ (September 1995) «Interaction between the components of the interferon gamma receptor complex». The Journal of Biological Chemistry 270 (36): 20915–21. doi:10.1074/jbc.270.36.20915. PMID 7673114.
- ↑ (March 2016) «IL18 Gene Variants Influence the Susceptibility to Chagas Disease». PLOS Neglected Tropical Diseases 10 (3): e0004583. doi:10.1371/journal.pntd.0004583. PMID 27027876.
- ↑ (November 2012) «Investigations of seborrheic dermatitis. Part I. The role of selected cytokines in the pathogenesis of seborrheic dermatitis». Postepy Higieny I Medycyny Doswiadczalnej 66: 843–7. doi:10.5604/17322693.1019642. PMID 23175340.
- ↑ (January 2002) «Human interferon-gamma mRNA autoregulates its translation through a pseudoknot that activates the interferon-inducible protein kinase PKR». Cell 108 (2): 221–32. doi:10.1016/S0092-8674(02)00616-5. PMID 11832212.
- ↑ (April 2008) «MicroRNA targets in immune genes and the Dicer/Argonaute and ARE machinery components». Molecular Immunology 45 (7): 1995–2006. doi:10.1016/j.molimm.2007.10.035. PMID 18061676.
- ↑ (June 2013) «Posttranscriptional control of T cell effector function by aerobic glycolysis». Cell 153 (6): 1239–51. doi:10.1016/j.cell.2013.05.016. PMID 23746840.
Литература
- Hall, Stephen K. A commotion in the blood: life, death, and the immune system. — New York : Henry Holt, 1997. — ISBN 978-0-8050-5841-3.
- (April 2002) «The roles of IFN gamma in protection against tumor development and cancer immunoediting». Cytokine & Growth Factor Reviews 13 (2): 95–109. doi:10.1016/S1359-6101(01)00038-7. PMID 11900986.
- (December 2002) «The role of IFN-gamma in immune responses to viral infections of the central nervous system». Cytokine & Growth Factor Reviews 13 (6): 441–54. doi:10.1016/S1359-6101(02)00044-8. PMID 12401479.
- (October 2004) «Interleukin-13 in the skin and interferon-gamma in the liver are key players in immune protection in human schistosomiasis». Immunological Reviews 201: 180–90. doi:10.1111/j.0105-2896.2004.00195.x. PMID 15361241.
- (January 2005) «Nef: "necessary and enforcing factor" in HIV infection». Current HIV Research 3 (1): 87–94. doi:10.2174/1570162052773013. PMID 15638726.
- (December 2005) «Modulation of HIV-1 transcription by cytokines and chemokines». Mini Reviews in Medicinal Chemistry 5 (12): 1093–101. doi:10.2174/138955705774933383. PMID 16375755.
- (January 2006) «The significance of interferon-gamma-triggered internalization of tight-junction proteins in inflammatory bowel disease». Science's STKE 2006 (316): pe1. doi:10.1126/stke.3162006pe1. PMID 16391178.
- (March 2007) «Interferon-gamma axis in graft arteriosclerosis». Circulation Research 100 (5): 622–32. doi:10.1161/01.RES.0000258861.72279.29. PMID 17363708.