Изохорный процесс
Изохо́рный, или изохори́ческий проце́сс (от др.-греч. ἴσος — «равный» и χώρος — «место») — термодинамический изопроцесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать или охлаждать вещество в сосуде неизменного объёма.
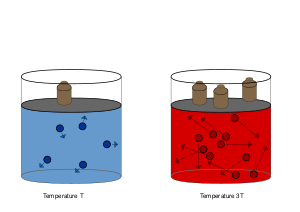
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля выполняется приближённо.
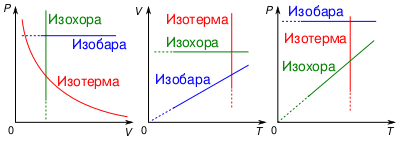
На графиках в координатах состояния ([math]\displaystyle{ P-V,\ P-T,\ V-T }[/math]) изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: [math]\displaystyle{ T }[/math] (температура), [math]\displaystyle{ V }[/math] (объем) и [math]\displaystyle{ P }[/math] (давление).
История
Наиболее часто первые исследования изохорного процесса связывают с Гийомом Амонтоном. В своей работе «Парижские мемуары» в 1702 году он описал поведение газа в фиксированном объёме[Комм 1] внутри так называемого «воздушного термометра». Жидкость в нём находится в равновесии под воздействием давления газа в резервуаре и атмосферным давлением. При нагревании давление в резервуаре увеличивается, и жидкость вытесняется в выступающую трубку. Зависимость между температурой и давлением была установлена в виде[1][Комм 2]:
- [math]\displaystyle{ \frac{p_1}{p_2}=\frac{1+\alpha t_1}{1+\alpha t_2}. }[/math]
В 1801 году Джон Дальтон в двух своих эссе опубликовал эксперимент, в котором установил, что все газы и пары, исследованные им при постоянном давлении, одинаково расширяются при изменении температуры, если начальная и конечная температура одинакова[2][3][4]. Данный закон получил название закона Гей-Люссака, так как Гей-Люссак вскоре провёл самостоятельные эксперименты и подтвердил одинаковое расширение различных газов, причём получив практически тот же самый коэффициент, что и Дальтон[4]. Впоследствии он же объединил свой закон с законом Бойля — Мариотта[5], что позволило описывать в том числе и изохорный процесс.
Термодинамика процесса
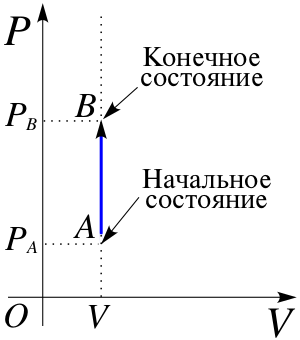
Из определения работы следует, что элементарная работа при термодинамическом процессе равна[6][Комм 3]:
- [math]\displaystyle{ \delta A = P dV. }[/math]
Чтобы определить полную работу процесса проинтегрируем данное выражение[6]:
- [math]\displaystyle{ A = \int\limits_{V_1}^{V_1}PdV, }[/math]
но, поскольку объём неизменен, то есть [math]\displaystyle{ \Delta V = 0 }[/math], то такой интеграл равен нулю. Поэтому при изохорном процессе газ работы не совершает[7]:
- [math]\displaystyle{ A=0. }[/math]
Это же можно показать на графике изохорного процесса. С математической точки зрения, работа процесса равна площади такого графика[6]. Но график изохорного процесса является прямой перпендикулярной к оси объёма. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле[8]:
- [math]\displaystyle{ \Delta U=\frac{i}{2}\nu R\Delta T, }[/math]
- где [math]\displaystyle{ i }[/math] — число степеней свободы, которое зависит от количества атомов в молекуле газа (3 — для одноатомной (например, неон), 5 — для двухатомной (например, кислород) и 6 — для трёхатомной и более (например, молекула углекислого газа)).
Из определения и формулы теплоёмкости формулу для внутренней энергии можно переписать в виде[8]:
- [math]\displaystyle{ \Delta U=\nu\ c_v^{\mu}\ \Delta T, }[/math]
- где [math]\displaystyle{ c_v^{\mu} }[/math] — молярная теплоёмкость при постоянном объёме.
Используя первое начало термодинамики можно найти количество теплоты при термодинамическом процессе[9]:
- [math]\displaystyle{ Q =\Delta U + A. }[/math]
Но при изохорном процессе газ не выполняет работу[7]. То есть, имеет место равенство:
- [math]\displaystyle{ Q = \Delta U = \nu\ c_v^{\mu}\ \Delta T, }[/math]
таким образом, вся теплота, которую получает газ, идёт на изменение его внутренней энергии.
Энтропия при изохорном процессе
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует[10]:
- [math]\displaystyle{ dS = {\delta Q \over T}, }[/math]
Выше была выведена формула для определения количества теплоты. Если её переписать в дифференциальном виде[12][Комм 4]:
- [math]\displaystyle{ \delta Q = \nu\ c_v^{\mu}\ dT, }[/math]
- где [math]\displaystyle{ \nu }[/math] — количество вещества,
- [math]\displaystyle{ c_v^\mu }[/math] — молярная теплоемкость при постоянном объёме.
Микроскопическое изменение энтропии при изохорном процессе можно определить по формуле[12]:
- [math]\displaystyle{ dS = {\nu\ c_v^{\mu}\ dT \over T}dy/dx\ dy/dx. }[/math]
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе[12]:
- [math]\displaystyle{ \int\limits_{S_1}^{S_2} dS = \nu \int\limits_{T_1}^{T_2}{c_v^{\mu}\ dT \over T} \Rightarrow \Delta S=\nu\int\limits_{T_1}^{T_2}{c_v^{\mu}\ dT \over T}. }[/math]
В данном случае выносить выражение молярной теплоемкости при постоянном объёме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
Практическое применение теории изохорного процесса

При идеальном цикле Отто, который приближённо воспроизведён в бензиновом двигателе внутреннего сгорания, такты 2—3 и 4—1 являются изохорными процессами.
Работа, совершаемая на выходе двигателя, равна разности работ, которую произведёт газ над поршнем во время третьего такта (то есть рабочего хода), и работы, которую затрачивает поршень на сжатие газа во время второго такта. Так как в двигателе, работающем по циклу Отто используется система принудительного зажигания смеси, то происходит сжатие газа в 7—12 раз[13].

В цикле Стирлинга также присутствуют два изохорных такта. Для его осуществления в двигателе Стирлинга добавлен регенератор. Газ, проходя через наполнитель в одну сторону, отдаёт тепло от рабочего тела к регенератору, а при движении в другую сторону отдаёт его обратно рабочему тему[14]. Идеальный цикл Стирлинга достигает обратимости и тех же величин КПД что и цикл Карно[15].
См. также
Примечания
Комментарии
- ↑ В приведённом опыте изменения объёма пренебрежимо малы по сравнению с изменением давления
- ↑ При эксперименте использовалась шкала температур в градусах Цельсия, а не Кельвина
- ↑ Перейти обратно: 3,0 3,1 . Также используются обозначения [math]\displaystyle{ d^\prime Q }[/math] и [math]\displaystyle{ d^\prime A }[/math]
- ↑ В источнике даны формулы для всех термодинамических процессов. В частности, данная формула в полном виде имеет значение [math]\displaystyle{ \delta Q = \nu\ c_v^{\mu}\ dT \, + PdV }[/math], но при изохорном процессе [math]\displaystyle{ dV=0 }[/math]
Источники
- ↑ Кудрявцев, 1956, с. 292—293.
- ↑ J. Dalton, 1802, с. 550—574.
- ↑ J. Dalton, 1802, с. 595—602.
- ↑ Перейти обратно: 4,0 4,1 Кудрявцев, 1956, с. 393.
- ↑ Кудрявцев, 1956, с. 396.
- ↑ Перейти обратно: 6,0 6,1 6,2 Савельев, 2001, с. 19—21.
- ↑ Перейти обратно: 7,0 7,1 Савельев, 2001, с. 37.
- ↑ Перейти обратно: 8,0 8,1 Савельев, 2001, с. 61.
- ↑ Савельев, 2001, с. 17.
- ↑ Савельев, 2001, с. 93.
- ↑ Савельев, 2001, с. 18.
- ↑ Перейти обратно: 12,0 12,1 12,2 Сивухин, 1975, с. 128.
- ↑ Кириллин, 2008.
- ↑ Romanelli, 2017.
- ↑ Крестовников А. Н., Вигдорович В. Н., Химическая термодинамика, 1973, с. 63.
Список литературы
- Кириллин В. А., Сычёв В. В., Шейндлин А. Е. Техническая термодинамика: учебник для вузов. — М.: Издательство МЭИ, 2008. — 496 с. Архивная копия от 24 ноября 2011 на Wayback Machine
- Крестовников А. Н., Вигдорович В. Н. Химическая термодинамика. — 2-е изд., испр. и доп. — М.: Металлургия, 1973. — 256 с.
- Кудрявцев П. С. История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — Издание 5-е. — М.: Физматлит, 2005. — 616 с. — («Теоретическая физика», том V). — ISBN 5-9221-0054-8.
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- J. Dalton. 2 // Memoirs of the Literary and Philosophical Society of Manchester. — 1802. — Т. 5. — 701 с.
- Alejandro Romanelli. Alternative thermodynamic cycle for the Stirling machine. — Montevideo, Uruguay: Instituto de F´ısica, Facultad de Ingenier´ıa Universidad de la Rep´ublica, 2017.
