Закон Гей-Люссака
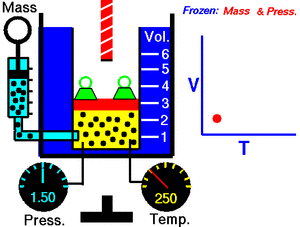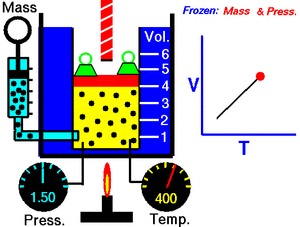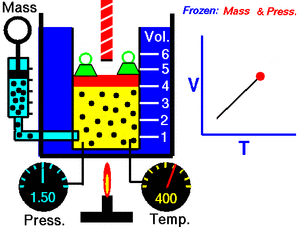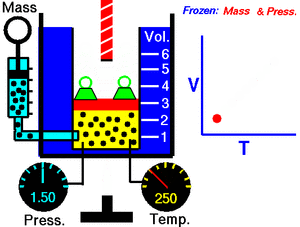
Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении (то есть в изобарном процессе), названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году.
Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений.
Неоднозначность терминологии
В русско- и англоязычной научной литературе существуют некоторые различия в наименовании законов, связанных с именем Гей-Люссака. Эти различия представлены в следующей таблице.
| Русскоязычное название | Англоязычное название | Формула |
|---|---|---|
| Закон Гей-Люссака | Закон Шарля (Charles's law) Закон Гей-Люссака Закон объёмов (Volumes Law) |
[math]\displaystyle{ V/T=\mathrm{const} }[/math] |
| Закон Шарля | Закон Гей-Люссака (Gay-Lussac's law) Второй закон Гей-Люссака |
[math]\displaystyle{ P/T=\mathrm{const} }[/math] |
| Закон объёмных отношений | Закон Гей-Люссака (Gay-Lussac's law) |
История открытия
Неоднозначность терминологии связана с историей открытия газовых законов. Закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) впервые был опубликован в открытой печати в 1802 году Гей-Люссаком[1], однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века.
За кем бы ни оставался приоритет этого открытия, Гей-Люссак первым продемонстрировал, что закон применим ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения. Математически он выразил своё открытие так:
- [math]\displaystyle{ \ V_{100}-V_0=kV_0, }[/math]
где [math]\displaystyle{ V_{100} }[/math] — объём данного количества газа при температуре 100 °C; [math]\displaystyle{ V_0 }[/math] — объём того же газа при 0 °C; [math]\displaystyle{ k }[/math] — константа, одинаковая для всех газов при одинаковом давлении. Эта формулировка не использует понятие абсолютной температуры, поскольку в то время оно ещё не было введено.
Гей-Люссак дал для константы [math]\displaystyle{ k }[/math] значение [math]\displaystyle{ \frac1{2{,}6666} }[/math], что достаточно близко к современному значению, равному [math]\displaystyle{ \frac1{2{,}7315} }[/math].
Формулировка закона
Закон Гей-Люссака в современной формулировке утверждает, что при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Математически закон выражается следующим образом:
- [math]\displaystyle{ V\sim T }[/math]
или
- [math]\displaystyle{ \frac{V}{T}=\mathrm{const}, }[/math] P=const
где [math]\displaystyle{ V }[/math] — объём газа, [math]\displaystyle{ T }[/math] — температура,P–давление.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:
- [math]\displaystyle{ \frac{V_1}{T_1}=\frac{V_2}{T_2}\quad }[/math]
или
- [math]\displaystyle{ {V_1}{T_2}={V_2}{T_1} }[/math].
Закон объёмных отношений
Согласно закону объёмных отношений, если два газа участвуют в химической реакции, то отношение их объёмов, измеренных при одинаковой температуре и давлении образуют дробь, числитель и знаменатель которой являются небольшими целыми числами[2].
Этот закон отражает тот факт, что
- одинаковые объёмы газов при одинаковых температуре и давлении содержат одинаковые количества молекул (закон Авогадро);
- в химической реакции участвует целое количество молекул и на одну молекулу вещества приходится одинаковое количество молекул другого вещества (стехиометрия химической реакции), которое определяется коэффициентами уравнения реакции.
Примечания
- ↑ Gay-Lussac, J. L. Recherches sur la dilatation des gaz et des vapeurs // Annales de chimie. — 1802. — Vol. XLIII. — P. 137. Выдержки из статьи в английском переводе. Архивная копия от 6 июня 2019 на Wayback Machine
- ↑ Gay-Lussac's Law of Combining Gas Volumes (англ.). Дата обращения: 22 декабря 2018. Архивировано 28 февраля 2019 года.
Литература
- Castka, Joseph F.; Metcalfe, H. Clark; Davis, Raymond E.; Williams, John E. Modern Chemistry (неопр.). — Holt, Rinehart and Winston[англ.], 2002. — ISBN 0-03-056537-5.
- Guch, Ian. The Complete Idiot's Guide to Chemistry (неопр.). — Alpha, Penguin Group Inc., 2003. — ISBN 1-59257-101-8.
- Mascetta, Joseph A. How to Prepare for the SAT II Chemistry (неопр.). — Barron's, 1998. — ISBN 0-7641-0331-8.