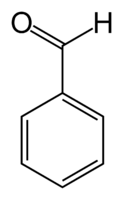
Бензойный альдегид
Эту статью необходимо исправить в соответствии с рекомендациями об оформлении статей. |
| Бензойный альдегид | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Бензальдегид | ||
| Традиционные названия |
Бензойный альдегид, фенилметаналь |
||
| Хим. формула | C6H5CHO | ||
| Рац. формула | C7H6O | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость с приятным миндальным запахом | ||
| Молярная масса | 106.12 г/моль | ||
| Плотность | 1.0415 г/см³ | ||
| Динамическая вязкость | 0.14 Па·с | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −26 °C | ||
| • кипения | 178.1 °C | ||
| • вспышки | 62 °C | ||
| Критическая точка | 412°С | ||
| Удельная теплота испарения | 39,7 Дж/кг | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,3 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,5455 | ||
| Классификация | |||
| Рег. номер CAS | 100-52-7 | ||
| SMILES |
|
||
| Безопасность | |||
| ЛД50 |
1300 мг/кг(крысы, перорально), 1250 мг/кг (крысы, подкожно) |
||
| Токсичность | токсичен, вызывает раздражение кожи | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бензойный альдегид (бензальдегид) C6H5CHO — простейший альдегид ароматического ряда, молекулярная масса 106,12, бесцветная жидкость с характерным запахом горького миндаля или яблочных косточек, желтеющая при хранении и окисляющаяся кислородом воздуха до перекиси бензоила (взрывоопасна), в дальнейшем превращающейся в бензойную кислоту.
История
Был исследован в 1840х годах Николаем Николаевичем Зининым.
Физические свойства
Т.пл. −26 градусов Цельсия, Т.кип. 179 градусов Цельсия. Растворяется в этаноле, эфире и других органических растворителях.
Растворимость в воде при н.у. 0,3 %. Образует азеотропные смеси с орто-крезолом, бензилхлоридом, фенолом и другими органическими веществами.
Химические свойства
Для бензальдегида характерны реакции с участием карбонильной группы. Так, например, бензальдегид взаимодействует с NaHSO3, HCN, образуя соответствующие продукты.
- C6H5CHO + HCN = C6H5CH(OH)CN
Помимо этого бензальдегид реагирует с другими нуклеофильными реагентами, вступая в реакции конденсации. С реактивами Гриньяра бензальдегид дает соответствующие вторичные спирты.
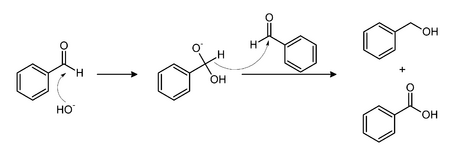
Под действием щелочи бензальдегид вступает в реакцию Канниццаро образуя бензиловый спирт и бензойную кислоту.
Бензальдегид быстро окисляется на воздухе до бензойной кислоты. Нагревание в присутствии KCN приводит к бензоину:
- 2C6H5CHO = C6H5CH(OH)COC6H5.
С фенолами и третичными ароматическими аминами бензальдегид конденсируется с образованием производных трифенилметана, с уксусным ангидридом — с образованием коричной кислоты (реакция Перкина).
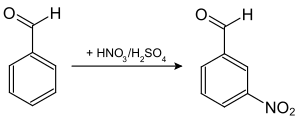
Бензальдегид способен вступать в реакции электрофильного замещения, причем реагирует он селективно, образуя мета-замещенные продукты.
Получение
Из природного сырья
Ядра косточек горького миндаля содержат гликозид амигдалин. В немного меньшем количестве он присутствует в косточках абрикосов, персиков, вишни, черешни и др. косточковых. Определить, что имеющиеся у вас косточки содержат амигдалин, можно по запаху напоминающему запах бензальдегида.
- C6H5CH(CN)O-C12H21O10 (гликозид амигдалин) + ферментативный гидролиз (ферменты уже содержатся в самих косточках) = C6H5CHO + HCN + сахар.
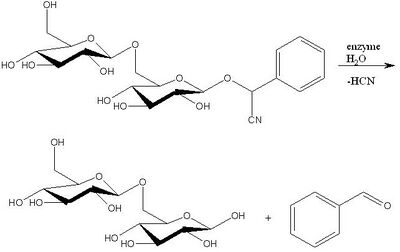
Далее растворимыми солями железа осаждается нерастворимый в воде гексацианоферрат железа и бензальдегид отгоняется с водяным паром.
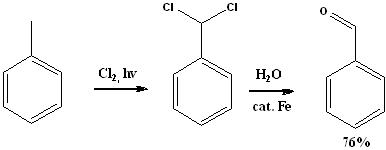
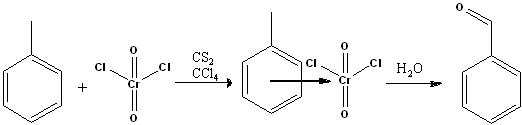
Из толуола
- C7H8 + Cl2 + свет = C6H5CHCl2 (бензальхлорид) + гидролиз H2O (кат. порошок Fe, бензоат Fe) = (выход 76%) C6H5CHO
- C7H8 + MnO2 + H2SO4 65% (t40°C) = C6H5CHO
- C7H8 + 2CrO2Cl2 (хромил хлорид) (в сероуглероде, тетрахлорметане) (t25-45°C) = осадок C6H5CH3*(CrO2Cl2)2 + H2O = C6H5CHO (выход 70-80%)
- C7H8 + CrO3 + (CH3CO)2O + CH3COOH (t5-10°C) = C6H5CH(OOCCH3)2 + HCl (гидролиз) = C6H5CHO
- пары
C7H8 + воздух + кат. V2O5; 350-500°С = C6H5CHO

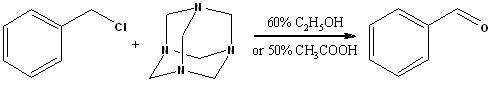
Из бензилгалогенидов
- C6H5CH2Cl + Pb(NO3)2 водн.; HNO3 разб.; 100°С = C6H5CH2ONO2 + NaOH = C6H5CHO
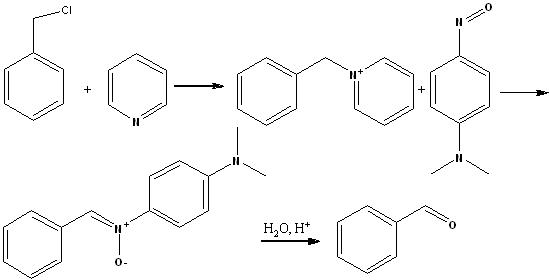
- C6H5CH2Cl + C6H12N4(уротропин) (в кипящем 60% C2H5OH или в 50% CH3COOH) = C6H5CHO
- C6H5CH2Cl + C5H5N(пиридин) = [C5H5N+CH2C6H5]Cl- + n-ONC6H4N(CH3)2(п-нитрозодиметиланилин) = C6H5CH=N+(O-)C6H4N(CH3)2 + H2O(H+) = C6H5CHO
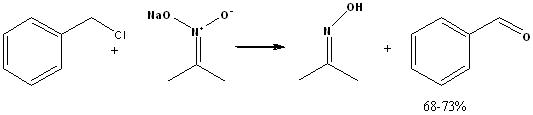
- C6H5CH2Cl + (CH3)2C=N+(ONa)O-(натриевое производное 2-нитропропана) = (CH3)2C=NOH + NaCl + C6H5CHO(выход 68-73%)
Прямое формилирование бензола и его гомологов
- C6H6 + CO + HCl + катализатор (AlCl3 + CuCl) = n-CH3C6H4CHO(выход 50-55%) - реакция Гаттермана-Коха
- HCOOCH3 + PCl5 = CHCl2OCH3(дихлорметилметиловый эфир) + POCl3
C6H6 + CHCl2OCH3(дихлорметилметиловый эфир) + катализатор(AlCl3,TiCl4,SnCl4) в CH2Cl2 или CS2, 0°C = C6H5CHO
- (C6H5CH3 + NaCN + AlCl3 + HCl при 100°С = n-CH3C6H4CHO(выход 39%), (выход незамещенного бензальдегида из бензола 11-39%)
- C6H5OCH3(анизол) + NaCN + AlCl3 + HCl при 40-45°С = CH3OC6H4CHO(анисовый альдегид, выход почти количественный), (реакция хорошо работает на фенолах и их эфирах)
- HCON(CH3)2(диметилформамид) + POCl3 (экзотермическая реакция) + ArH = ArCH(OPOCl2)(N+H(CH3)2Cl-) + H2O = ArCHO + NH(CH3)2 + H3PO4
Из хлорангидридов кислот, сложных эфиров, нитрилов, спиртов, фенолов
- ArCOCl(хлорангидрид) + C6H5NH2(анилин) = ArCO-NHC6H5(анилид) + PCl5 = ArCCl=NC6H5(иминохлорид) + SnCl2(безводный) = ArCH=NC6H5(анил) + H2O = C6H5NH2 + ArCOH (выделение промежуточных продуктов необязательно) (выход 62%)
- ArCOOC2H5(сложный эфир) + NH2-NH2(гидразин) = ArCO-NHNH2(гидразид) + C6H5SO2Cl(бензолсульфохлорид) = ArCO-NHNH-SO2C6H5 + KOH = ArCOH + N2 + C6H5SO2OK (выходы 40-85%)
- C6H5CN + SnCl2(безводный) + HCl (в эфире) = [C6H5CH=NH2]2SnCl6 + H2O = C6H5CHO (выход хороший)
- C6H5CH2OH(бензиловый спирт) + NO2 (в хлороформе при 0°C) = C6H5CH(OH)NO2 = C6H5CHO (выходы альдегидов выше 90%, независимо от природы замещающих групп и пространственных затруднений)
Нахождение в природе
Производные бензойного альдегида содержатся в горьком миндале, листьях черёмухи, в мякоти гриба вёшенки обыкновенной и вишни.
Применение
- прекурсор для других органических реагентов, например, для синтеза миндальной кислоты
- для синтеза красителей, душистых веществ
- в парфюмерно-косметических композициях,
- как пищевой ароматизатор,
- как растворитель
- применяется для синтеза амфетамина
Техника безопасности
Температура самовоспламенения 205 °С; КПВ 1-3%; температурные пределы взрываемости 58-80°С. Бензальдегид раздражает глаза и верхние дыхательные пути. ПДК 5 мг/м3; ЛД50 1,3 г/кг (крысы, перорально); смертельная доза для человека 50-60 грамм.
Охрана труда
По данным 3-го издания «Большой медицинской энциклопедии» запах этого вещества отчётливо различается при концентрации 3 мг/м3[1]; в то время как по нормативам Роспотребнадзора ПДК 5 мг/м3[2].
Литература
- Бензойный альдегид // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Примечания
- ↑ Уланова И. П. Бензальдегид // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1976. — Т. 3 : Беклемишев — Валидол. — С. 36—37. — 584 с. : ил.
- ↑ (Роспотребнадзор). № 245. Бензальдегид // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 20. — 170 с. — (Санитарные правила). Архивная копия от 12 июня 2020 на Wayback Machine