Нитрование
Нитрование — реакция введения нитрогруппы —NO2 в молекулы органических соединений.
Реакция нитрования может протекать по электрофильному, нуклеофильному или радикальному механизму, при этом активной частицей в данных реакциях являются соответственно катион нитрония NO2+, нитрит-ион NO2- или радикал NO2•. Процесс заключается в замещении атома водорода у атомов C, N, O или присоединении нитрогруппы по кратной связи.
Электрофильное нитрование
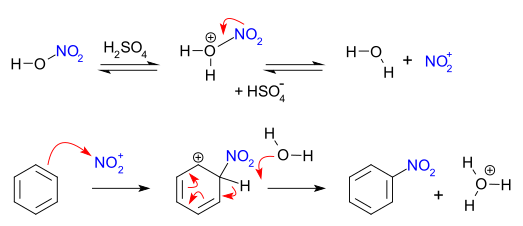
При электрофильном нитровании основным нитрующим агентом является азотная кислота. Безводная азотная кислота подвергается автопротолизу по реакции:
- [math]\displaystyle{ \mathsf{2HNO_3 \rightleftarrows [H_2NO_3]^+ + NO_3^- \rightleftarrows NO_2^+ + NO_3^- + H_2O} }[/math]
Вода сдвигает равновесие влево, поэтому в 93-95 % азотной кислоте катион нитрония уже не обнаруживается. В связи с этим азотная кислота используется в смеси со связывающей воду концентрированной серной кислотой или олеумом: в 10%-ном растворе азотной кислоты в безводной серной кислоте равновесие практически полностью сдвинуто вправо.
Кроме смеси серной и азотной кислот используются различные комбинации оксидов азота и органических нитратов с кислотами Льюиса (AlCl3, ZnCl2, BF3). Сильными нитрующими свойствами обладает смесь азотной кислоты с уксусным ангидридом, в которой образуется смесь ацетилнитрата и оксида азота(V), а также смесь азотной кислоты с оксидом серы(VI) или оксидом азота(V).
Процесс проводят либо при непосредственном взаимодействии нитрующей смеси с чистым веществом, либо в растворе последнего в полярном растворителе (нитрометан, сульфолан, уксусная кислота). Полярный растворитель кроме того, что растворяет реагирующие вещества, сольватирует ион [H2NO3]+ и способствует его диссоциации.
В лабораторных условиях чаще всего используются нитраты и соли нитрония, нитрующая активность которых возрастает в следующем ряду:
- [math]\displaystyle{ \mathsf{AlkONO_2 \lt (CH_3)_2C(CN)ONO_2 \lt RC(NO_2)_3, RN(NO_2)_2 \lt NO_2F \lt CH_3COONO_2 \lt N_2O_5 \lt NO_2^+X^-} }[/math]
Механизм нитрования бензола:
Кроме замещения атома водорода нитрогруппой применяется также заместительное нитрование, когда нитрогруппа вводится вместо сульфо-, диазо- и других групп.
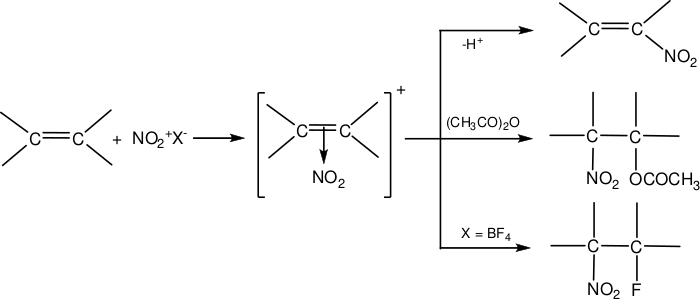
Нитрование алкенов при действии апротонных нитрующих агентов идёт по нескольким направлениям, которое зависит от условий реакции и строения исходных реагентов. В частности, могут протекать реакции отщепления протона и присоединения функциональных групп молекул растворителя и противоионов:
Нитрование аминов приводит к N-нитроаминам. Этот процесс является обратимым:
- [math]\displaystyle{ \mathsf{R_2NH + NO_2^+ \rightleftarrows [R_2N \cdot \cdot \cdot NO_2]^+ \rightleftarrows [R_2NHNO_2]^+ \rightleftarrows R_2NNO_2 + H^+} }[/math]
Нитрование аминов проводят концентрированной азотной кислотой, а также её смесями с серной кислотой, уксусной кислотой или уксусным ангидридом. Выход продукта увеличивается при переходе от сильноосновных аминов к слабоосновным. Нитрование третичных аминов идёт с разрывом связи C-N (реакция нитролиза); эта реакция используется для получения взрывчатых веществ - гексогена и октогена - из уротропина.
Заместительное нитрование ацетамидов, сульфамидов, уретанов, имидов и их солей протекает по схеме
- [math]\displaystyle{ \mathsf{R_2NX + NO_2Y \rightarrow R_2NNO_2 + XY \ \ \ X= SO_2R, COAlk, OCOAlk, Si(Alk)_3; \ \ \ Y=F, NO_3, BF_4} }[/math]
Реакцию ведут в апротонных растворителях с использованием апротонных нитрующих агентов.
Спирты нитруются любыми нитрующими агентами; реакция является обратимой:
- [math]\displaystyle{ \mathsf{RCH_2OH + NO_2X \rightleftarrows RCH_2ONO_2+ HX} }[/math]
Нуклеофильное нитрование
Эта реакция используется для синтеза алкилнитритов. Нитрующими агентами в этом типе реакций являются соли нитриты щелочных металлов в апротонных диполярных растворителях (иногда - в присутствии краун-эфиров). Субстратами являются алкилхлориды и алкилиодиды, α-галогенкарбоновые кислоты и их соли, алкилсульфаты. Побочными продуктами реакции являются органические нитриты.
Радикальное нитрование
Радикальное нитрование применяется для получения нитроалканов и нитроалкенов. Нитрующими агентами являются азотная кислота или оксиды азота. Процесс идёт по разветвлённому радикально-цепному механизму:
- [math]\displaystyle{ \mathsf{RH + NO_2 \cdot \xrightarrow[]{k_0} R\cdot + HNO_2} }[/math]
- [math]\displaystyle{ \mathsf{R\cdot + NO_2\cdot \xrightarrow[]{k_1} RNO_2} }[/math]
- [math]\displaystyle{ \mathsf{R\cdot + NO_2 \xrightarrow[]{k_2} RO\cdot + NO\cdot} }[/math]
- [math]\displaystyle{ \mathsf{RO\cdot + NO\cdot \xrightarrow[]{k_{2'}} RONO} }[/math]
- [math]\displaystyle{ \mathsf{RO\cdot + NO_2 \xrightarrow[]{k_{2''}} RONO_2} }[/math]
- [math]\displaystyle{ \mathsf{RO\cdot + RH \xrightarrow[]{k_3} ROH + R\cdot} }[/math]
- [math]\displaystyle{ \mathsf{RO\cdot \xrightarrow[]{k_4} R'CHO + R''\cdot} }[/math]
- [math]\displaystyle{ \mathsf{R'CHO + NO_2 \xrightarrow[]{k_5} R'CO\cdot + HNO_2} }[/math]
- [math]\displaystyle{ \mathsf{R'CO\cdot \xrightarrow[]{k_6} R'\cdot + CO} }[/math]
- [math]\displaystyle{ \mathsf{HNO_2 \rightarrow HO\cdot + NO\cdot} }[/math]
- [math]\displaystyle{ \mathsf{R'\cdot + NO \xrightarrow[]{k_8} R'NO} }[/math]
- [math]\displaystyle{ \mathsf{HNO_2 + HNO_3 \rightarrow 2NO_2\cdot + H_2O} }[/math]
Параллельно протекает реакция окисления алканов ввиду взаимодействия радикала NO2• с алкильным радикалом по атому не азота, а кислорода. Реакционноспособность алканов возрастает при переходе от первичных к третичным. Реакцию проводят как в жидкой фазе (азотной кислотой при нормальном давлении или оксидами азота, при 2-4,5 МПа и 150-220°C), так и в газовой (пары азотной кислоты, 0,7-1,0 МПа, 400-500°C).
Нитрование алкенов по радикальному механизму проводят 70-80%-ной азотной кислотой, иногда - разбавленной азотной кислотой в присутствии оксидов азота. Циклоалкены, диалкил- и диарилацетилены нитруют оксидом N2O4, при этом образуются цис- и транс-нитросоединения, побочные продукты образуются ввиду окисления и деструкции исходных субстратов.
Анион-радикальный механизм нитрования наблюдается при взаимодействии тетранитрометана солей моно-нитросоединений.
См. также
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.