Азосоединения

Азосоединения — класс органических соединений общей формулы R1—N=N—R2, формально — производные нестойкого диазена (диимида) HN=NH, у которого оба атома водорода замещены органическими радикалами[1]. Простейшее алифатическое азосоединение — азометан[нем.] Н3C—N=N—CH3; простейшее ароматическое азосоединение — азобензол C6H5—N=N—C6H5.
Ароматические азосоединения интенсивно окрашены и применяются в качестве красителей и пигментов.
Номенклатура
Названия азосоединений образуются в соответствии с заместительной номенклатурой, для обозначения азогруппы —N=N— в названиях используется частица -азо-. Симметричные азосоединения R—N=N—R именуются добавлением префикса азо- к названию соединения-предшественника радикала R. Например, если R — метил (то есть предшественником радикала является метан), то азосоединение называется «азометан»; если R — 1-нафтил, то соответствующее азосоединение — 1,1-азонафталин. Если заместители у азогруппы различны, то название образуется из имени «старшего»[прояснить] заместителя, частицы -азо- и имени «младшего» заместителя, например, нафталин-1-азобензол.
Свойства
Атомы азота в азогруппе sp2-гибридизованы, π-связь образуется при участии pz-орбиталей, таким образом, при отсутствии стерических затруднений все связи азогруппы —N=N— расположены в одной плоскости. Как и в случае алкенов, для азосоединений характерна геометрическая изомерия, более стабильными являются транс-изомеры, которые могут изомеризоваться в цис-форму при облучении видимым светом или ультрафиолетом с длиной волны, соответствующей области поглощения перехода n → π*.
Возможность перехода n → π*, обусловленного наличием неподелённых электронных пар, ведет к появлению слабой (вследствие запрещённости по симметрии перехода) полосы поглощения: в алифатических азосоединениях — в области 160—300 нм, у цис- и транс-азобензолов — при 432 и 450 нм.
Электронный переход π → π* азогруппы ведет к появлению в УФ-спектрах ароматических азосоединений интенсивной полосы при 280—320 нм, которая при введении сопряжённых с азогруппой электрондонорных заместителей ведет к батохромному сдвигу и усилению поглощения азосоединения. Такие соединения используются в качестве красителей.
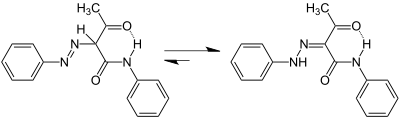
Для азосоединений, несущих в заместителе сопряжённый с азогруппой подвижный атом водорода, возможна таутомерия азо- и гидразонной форм (азо-гидразонная таутомерия):
Реакционная способность
Алифатические азосоединения при нагревании или при облучении ультрафиолетом разлагаются с выделением азота и образованием свободных радикалов, поэтому некоторые из них, в частности, 2,2'-азо-бис-изобутиронитрил, разлагающийся при 60—100 °C, используются в качестве инициаторов радикальной полимеризации:
Термическое разложение симметричных алифатических азосоединений также используется в синтетической практике для получения алифатических соединений путём рекомбинации образующихся при их разложении радикалов[2]:
- [math]\displaystyle{ \mathsf{R\text{-}N\text{=}N\text{-}R \rightarrow R\text{-}R + N_2} }[/math]
Ароматические азосоединения более стабильны за счет сопряжения — так, бензолазоэтан C6H5—N=N—C2H5 кипит при 180 °C почти без разложения.
Алифатические азосоединения с атомами водорода в α-положении под действием кислот претерпевают перегруппировку в гидразоны:
- [math]\displaystyle{ \mathsf{R\text{-}CH_2\text{-}N\text{=}N\text{-}R' \rightarrow R\text{-}CH\text{=}N\text{-}NH\text{-}R'} }[/math]
Под действием восстановителей (NaBH4, цинк в щелочной среде и т. п.) азосоединения превращаются в гидразосоединения (1,2-замещённые гидразины):
- [math]\displaystyle{ \mathsf{R^1\text{-}N\text{=}N\text{-}R^2 + [H] \rightarrow R^1\text{-}NH\text{-}NH\text{-}R^2} }[/math]
В случае использования сильных восстановитей возможно восстановление in situ промежуточно образующихся гидразинов с образованием первичных аминов:
- [math]\displaystyle{ \mathsf{R^1\text{-}N\text{=}N\text{-}R^2 + [H] \rightarrow R^1\text{-}NH_2 + R^2NH_2} }[/math]
Мягкие окислители (например, пероксид водорода в уксусной кислоте, надкислоты) превращают азосоединения в азоксисоединения:
- [math]\displaystyle{ \mathsf{C_6H_5\text{-}N\text{=}N\text{-}C_6H_5 + H_2O_2 \rightarrow C_6H_5\text{-}N(O)\text{=}NC_6H_5 + H_2O} }[/math]
а сильные (дымящая азотная кислота на холоду) — в нитросоединения, разрушая азогруппу:
- [math]\displaystyle{ \mathsf{C_6H_5\text{-}N\text{=}N\text{-}C_6H_5 + 4Cl_2 + 4H_2O \rightarrow 2C_6H_5NO_2 + 8HCl} }[/math]
Электрондефицитные азосоединения — азокарбонильные соединения и, особенно, азодикарбоксилаты — выступают в качестве диенофилов в реакции Дильса — Альдера[3].
Синтез
Стандартным методом синтеза алифатических и алкиларилазосоединений является дегидрирование N,N'-дизамещенных гидразинов действием различных окислителей (дихромат калия, оксид ртути[какой?], бром, азотная кислота и др.):
- [math]\displaystyle{ \mathsf{R^1\text{-}NH\text{-}NH\text{-}R^2 + [O] \rightarrow R^1\text{-}N\text{=}\text{-}N\text{-}R^2} }[/math]
Функционализированные алифатические азосоединения могут быть получены хлорированием кетазинов с дальнейшим замещением хлора в образующихся при хлорировании α,α′-дихлоразосоединениях различными нуклеофилами:
- [math]\displaystyle{ \mathsf{R^1R^2C\text{=}N\text{-}N\text{=}CR^3R^4 + Cl_2 \rightarrow R^1R^2CCl\text{-}N\text{=}N\text{-}CClR^3R^4} }[/math]
- [math]\displaystyle{ \mathsf{R^1R^2CCl\text{-}N\text{=}N\text{-}CClR^3R^4 + 2X^- \rightarrow R^1R^2CX\text{-}N\text{=}N\text{-}CXR^3R^4} }[/math]
- [math]\displaystyle{ \mathsf{X = RS^-, \ CN^-, \ CH_3COO^-, \ R_3Al} }[/math]
Первый представитель ароматических азосоединений — азобензол — был впервые получен в 1834 году Э. Мичерлихом восстановлением нитробензола в щелочной среде, этот метод применяется и поныне[4]:
- [math]\displaystyle{ \mathsf{2ArNO_2 + [H] \rightarrow Ar\text{-}N\text{=}N\text{-}Ar + H_2O} }[/math]
Симметрично замещённые ароматические азосоединения также могут быть синтезированы окислением соответствующих ариламинов[5]:
- [math]\displaystyle{ \mathsf{2ArNH_2 + [O] \rightarrow Ar\text{-}N\text{=}N\text{-}Ar + H_2O} }[/math]
а несимметричные могут быть получены конденсацией ароматических аминов с нитрозосоединениями:
- [math]\displaystyle{ \mathsf{2ArNH_2 + Ar'\text{-}N\text{=}O \rightarrow Ar\text{-}N\text{=}N\text{-}Ar' + H_2O} }[/math]
Наиболее широко применяемым методом синтеза функционализированных ароматических азосоединений является азосочетание — реакция диазониевых солей с ароматическими соединениями, несущими электрондонорные заместители, этот метод применяется в промышленности в синтезе азокрасителей:
Азокрасители
Азокрасители — органические соединения, содержащие одну или несколько азогрупп, например, конго красный, метиловый оранжевый, β-нафтолоранж и другие. Азокрасители разнообразны по цвету, как правило, не очень стойки. Азокрасители — самый многочисленный класс синтетических красителей, применяют для крашения тканей, кожи, бумаги, резины, в лакокрасочной, полиграфической и других отраслях, в аналитической химии как индикатор.
См. также
Примечания
- ↑ azo compounds // IUPAC Gold Book. Дата обращения: 19 апреля 2013. Архивировано 27 апреля 2013 года.
- ↑ C. G. Overberger and M. B. Berenbaum. 1,1'-Dicyano-1,1'-bicyclohexyl. Organic Syntheses, Coll. Vol. 4, p.273 (1963); Vol. 32, p.48 (1952). (недоступная ссылка). Дата обращения: 19 апреля 2013. Архивировано 11 февраля 2005 года.
- ↑ Hetero Diels-Alder Methodology in Organic Synthesis (англ.). — Elsevier Science, 1987. — P. 154—160. — ISBN 008091697X.
- ↑ H. E. Bigelow and D. B. Robinson. Azobenzene. Organic Syntheses, Coll. Vol. 3, p.103 (1955); Vol. 22, p.28 (1942). (недоступная ссылка). Дата обращения: 19 апреля 2013. Архивировано 14 января 2011 года.
- ↑ 4,4'-Diaminoazobenzene. Organic Syntheses, Coll. Vol. 5, p.341 (1973); Vol. 40, p.18 (1960). (недоступная ссылка). Дата обращения: 19 апреля 2013. Архивировано 14 января 2011 года.