Фосфофруктокиназа
| Фосфофруктокиназа | |
|---|---|
| Идентификаторы | |
| Символ | Ppfruckinase |
| Pfam | PF00365 |
| InterPro | IPR000023 |
| PROSITE | PDOC00336 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Фосфофруктокиназа (англ. Phosphofructokinase, PFK) — фермент-киназа, отвечающий за фосфорилирование фруктозо-6-фосфата в процессе гликолиза.
Фосфофруктокиназы катализируют перенос фосфатной группы от АТФ к фруктозо-6-фосфату, что является одним из ключевых элементов гликолиза[1][2].
Дефицит фосфофруктокиназы ведет к гликогенозу VII типа (болезнь Таруи) — аутосомно-рецессивному заболеванию, симптомы которого включают тошноту, рвоту, мышечные спазмы и миоглобинурию при мышечных нагрузках[2]. Для борьбы с симптомами больным приходится регулировать свою физическую активность[2].
Регуляция
Существует два типа фосфофруктокиназ:
| Тип | Синонимы | Шифр КФ | Субстрат | Продукт | Фосфатаза | Гены субъединиц |
|---|---|---|---|---|---|---|
| Фосфофруктокиназа-1 | 6-фосфофруктокиназа фосфогексокиназа |
КФ 2.7.1.11 | 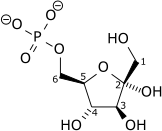 Фруктозо-6-фосфат |
 Фруктозо-1,6-бисфосфат |
Фруктозо-1,6-бисфосфатаза | PFKL, PFKM, PFKP |
| Фосфофруктокиназа-2 | 6-фосфофрукто-2-киназа | КФ 2.7.1.105 |  Фруктозо-2,6-бисфосфат |
Фосфофруктокиназа-2/Фруктозо-2,6-бисфосфатаза | PFKFB1, PFKFB2, PFKFB3, PFKFB4 |
Фосфофруктокиназы и соответствующие им фосфатазы играют важную роль в процессах гликолиза и глюконеогенеза.
Фосфофруктокиназа-1 и фруктозо-1,6-бисфосфатаза взаимно регулируются — при избыточном образовании АТФ в клетке, АТФ начинает ингибировать фосфофруктокиназу-1, что стимулирует глюконеогенез[3]. При превышении расхода АТФ над синтезом повышается концентрация АДФ и АМФ, которые снимают ингибирование фосфофруктокиназы-1 аденозинтрифосфатом[3]; высокая концентрация АМФ также приводит к ингибированию фруктозо-1,6-бисфосфатазы, что стимулирует гликолиз. Аллостерическим регулятором фосфофруктокиназы-1 является цитрат — он усиливает ингибирующее действие АТФ[3]. Кроме того, важным регулятором является фруктозо-2,6-бисфосфат, который активирует фосфофруктокиназу-1 и стимулирует гликолиз в печени, а также ингибирует фруктозо-1,6-бисфосфатазу, снижая её аффинность к субтрату[3].
Фосфофруктокиназа-2 — бифункциональный белок, который обладает активностью как киназы, так и фосфатазы[3]. Соотношение между этими активностями в печени регулируется глюкагоном и инсулином: глюкагон ингибирует гликолиз и стимулирует глюконеогенез, инсулин оказывает обратное действие[3].
Примечания
- ↑ Wegener G., Krause U. Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle (англ.) // Biochem. Soc. Trans. : journal. — 2002. — Vol. 30, no. 2. — P. 264—270. — doi:10.1042/bst0300264. — PMID 12023862.
- ↑ 2,0 2,1 2,2 Raben N., Exelbert R., Spiegel R., Sherman J. B., Nakajima H., Plotz P., Heinisch J. Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency (англ.) // Am. J. Hum. Genet. : journal. — 1995. — Vol. 56, no. 1. — P. 131—141. — PMID 7825568.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Нельсон, Кокс, 2014, с. 143—146.
Литература
- Дэвид Л. Нельсон, Майкл М. Кокс. Основы биохимии Ленинджера. — Бином, 2014. — Т. 2. — 633 с. — ISBN 978-5-94774-366-1.