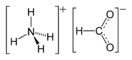Формиат аммония
| Формиат аммония | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Формиат аммония | ||
| Рац. формула | NH4HCO2 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 63,0559 г/моль | ||
| Плотность | 1,280 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 116 °C | ||
| • разложения | 180 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде |
(0 °C) 102 г/100 мл (80 °C) 531 г/100 мл |
||
| Классификация | |||
| Рег. номер CAS | 540-69-2 | ||
| SMILES | |||
| Безопасность | |||
| ЛД50 | 2250 мг/кг | ||
| Токсичность | Класс опасности IV | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Формиат аммония — аммонийная соль муравьиной кислоты, бесцветные, гигроскопичные кристаллы.
Получение
Образуется при пропускании аммиака через муравьиную кислоту. [math]\displaystyle{ \mathsf {NH_3 + HCOOH\rightarrow HCOONH_4} }[/math]
Использование
Чистый формиат аммония разлагается на воду и формамид при нагревании, в этом и есть его основное применение в промышленности. Формиат аммония также используется для восстановительного аминирования альдегидов и кетонов (реакция Лейкарта)[1]. Наряду с ацетатом аммония используется в качестве вещества, способствующего ионизации молекул в электроспрее.
Также формиат аммония может использоваться в качестве элюента для разделения бария и радия по методике Сугимуры и Цуботы[2].
Опасность
Относится к малоопасным веществам (IV класс опасности).
Примечания
- ↑ 1..3.1 Hydride Transfer from Formic Acid // Comprehensive organic synthesis. Selectivity, Strategy & Efficiency in Modern Organic Chemistry. — Kidlington, Oxford: Pergamon Press, 1991. — Vol. 8. — P. 84. — ISBN 0-08-040599-1.
- ↑ Sugimura Y., Tsubota H. J., Marine Res., 21, 74 (1963)