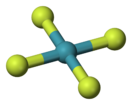
Фторид ксенона(IV)
| Фторид ксенона(IV) | |||
|---|---|---|---|
| - | |||

| |||
| Общие | |||
| Систематическое наименование |
Фторид ксенона(IV) | ||
| Хим. формула | XeF4 | ||
| Физические свойства | |||
| Состояние | бесцветные желтоватые кристаллы | ||
| Молярная масса | 207 г/моль | ||
| Плотность | 4,040 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • кипения | возгонка при 115,7 °C | ||
| Энтальпия | |||
| • образования | −252 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 13709-61-0 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тетрафтори́д ксено́на — соединение ксенона со фтором, представляющее собой при комнатной температуре бесцветные кристаллы со слабым желтоватым оттенком и чрезвычайно высокой химической активностью и агрессивностью. Самое устойчивое соединение ксенона. Чистый тетрафторид ксенона стабилен, однако во влажном воздухе гидролизуется с образованием оксифторидов ксенона.
Изучение
Структуру соединения исследовали с применением 19F-ЯМР-спектроскопии и рентгеноструктурного анализа в 1963 году.
Физические свойства
Получение
Синтез тетрафторида ксенона проводят смешиванием газов F2 и Xe в соотношении 2 к 1. Эта реакция экзотермична, выделяется 251 кДж/моль энергии.
Химические свойства
- Окисляет ртуть по реакции:
- [math]\displaystyle{ \mathsf{XeF_4 + 2Hg \rightarrow 2HgF_2 + Xe} }[/math]
- [math]\displaystyle{ \mathsf{XeF_4 + 2H_2 \rightarrow Xe + 4HF} }[/math]
- С платиной взаимодействует только в виде раствора в жидком фтороводороде:
- [math]\displaystyle{ \mathsf{XeF_4 + Pt \rightarrow PtF_4 + Xe} }[/math]
- Взаимодействует с водой
- В нейтральной среде[1]
- [math]\displaystyle{ \mathsf{XeF_4 + 2H_2O \rightarrow Xe + O_2 + 4HF} }[/math]
- В кислой среде
- [math]\displaystyle{ \mathsf{3XeF_4 + 8H_2O \rightarrow Xe + 2H_2XeO_4 + 12HF} }[/math]
- В щелочной среде
- [math]\displaystyle{ \mathsf{2XeF_4 + 2H_2O + 4NaOH \rightarrow Xe + Na_4XeO_6 + 8HF} }[/math]
- Количественно реагирует с иодидом калия:
- [math]\displaystyle{ \mathsf{4KI + XeF_4 \rightarrow 4KF + I_2 + Xe} }[/math]
Применение
Фториды ксенона находят применение как мощные окислители и фторирующие агенты. В виде фторидов удобно хранить и транспортировать чрезвычайно агрессивный фтор.
См. также
Ссылки
- ↑ 1,0 1,1 Xenon Tetrafluoride Claassen, Selig, Malm — J. Am. Chem. Soc., 1962, 84 (18), p 3593. Дата обращения: 16 марта 2009. Архивировано 13 июня 2022 года.
Литература
- Нейдинг А. Б., Фториды ксенона и радона. Успехи химии. 32, 501 (1963).
- Нейдинг А. Б., Соединения элементов нулевой группы. Успехи химии. 34,969 (1965).
- Нейдинг А. Б., Соколов В. Б., Соединения благородных газов. Успехи химии. 43, 2146 (1974).
- Химическая энциклопедия. [www.xumuk.ru/encyklopedia/2218.html Фториды ксенона].